Презентацию подготовила учитель химии МБОУ СОШ №28 г. Симферополя Лукашова Светлана Викторовна
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Количество вещества. Молярная масса (8 класс)
Содержание
- 1. Презентация по химии на тему Количество вещества. Молярная масса (8 класс)
- 2. Цель урока:
- 3. Моль – это такое количество вещества, в
- 4. Обозначение количества вещества и формулаЛюбое количество вещества
- 5. Молярная масса. Молярная масса вещества (M)
- 6. Основные формулыМолярную массу вещества можно вычислить, если
- 7. Значение молярной массы вещества определяется
- 8. Вычисления количества вещества по числу частиц и
- 9. Вычисления по химическим уравнениям.Задача. Вычислите массу воды
- 10. Закрепление материалаЗадача 1. Вычислите массу 24,08 •
- 11. Домашнее задание Отработать материал учебника, выполнить
Слайд 18 класс. Моль— единица количества вещества. Молярная масса. Вычисления по химическим
Слайд 2Цель урока:
Сформировать понятие о
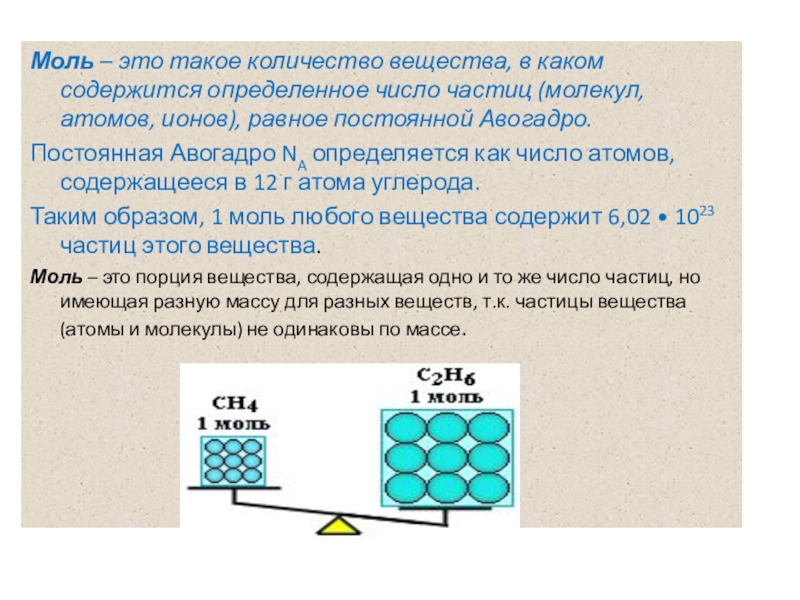
Слайд 3Моль – это такое количество вещества, в каком содержится определенное число
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г атома углерода.
Таким образом, 1 моль любого вещества содержит 6,02 • 1023 частиц этого вещества.
Моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
Слайд 4Обозначение количества вещества и формула
Любое количество вещества можно выразить определенным числом
В общем виде:
n = N/ NA,
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Слайд 5Молярная масса.
Молярная масса вещества (M) – масса, которую
Эта величина, равная отношению массы m вещества к количеству вещества n, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Слайд 6Основные формулы
Молярную массу вещества можно вычислить, если известны его масса m
M = m/ n
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
n = m/M
или найти массу вещества по числу молей и молярной массе:
m = n•M
Слайд 7 Значение молярной массы вещества определяется его качественным и количественным
Слайд 8Вычисления количества вещества по числу частиц и по массе, и обратных
Задача №1. Вычислите массу (г) железа, взятого количеством вещества 0, 5 моль?
Дано: n (Fe)=0,5 моль
Найти: m(Fe) - ?
Решение:
m = M · n
M(Fe) = Ar (Fe) = 56 г/моль (Из периодической системы)
m (Fe) = 56 г/моль · 0,5 моль = 28 г
Ответ: m (Fe) =28 г
Задача №2. Вычислите массу (г) 12,04 • 1023 молекул оксида кальция CaО?
Дано: N(CaO)= 12,04 • 1023 молекул
Найти: m(СaO) - ?
Решение:
m = M · n, n = N/Na,
следовательно, формула для расчёта
m = M · (N/Na)
M(CaO) = Ar(Ca) + Ar(O) = 40 + 16 = 56 г/моль
m= 56 г/моль · (12,04 • 1023/6.02 · 1023 1/моль) = 112 г
Ответ: m= 112 г
Слайд 9Вычисления по химическим уравнениям.
Задача. Вычислите массу воды (г), образованной при горении
Дано: 2Н2 + O2 = 2Н2O
n (Н2)=0,5 моль по уравнению из 2 моль Н2
m (Н2O) –? образуется 2 моль Н2O
из 0,5 моль Н2 – х моль Н2O
m (Н2O) = 0,5 моль · 18 г/моль = 9 г
Ответ. 9 г Н2O.
Слайд 10Закрепление материала
Задача 1. Вычислите массу 24,08 • 1023 молекул серной кислоты
Задача 2. Определите число атомов в 56 г железа Fe?
Задача 3. Вычислите объём кислорода, вступившего в реакцию с 4,4 г оксида углерода (IV).
Слайд 11Домашнее задание
Отработать материал учебника, выполнить упражнения после параграфа, решить
Творческое задание: написать сенкан по теме: «Моль».