- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Количество вещества
Содержание
- 1. Презентация по химии на тему Количество вещества
- 2. Слайд 2
- 3. Моль – это такое количество вещества, в
- 4. Слайд 4
- 5. Молярная масса-это масса одного моля вещества.М=[г/моль]( молярная
- 6. [ М] –
- 7. Слайд 7
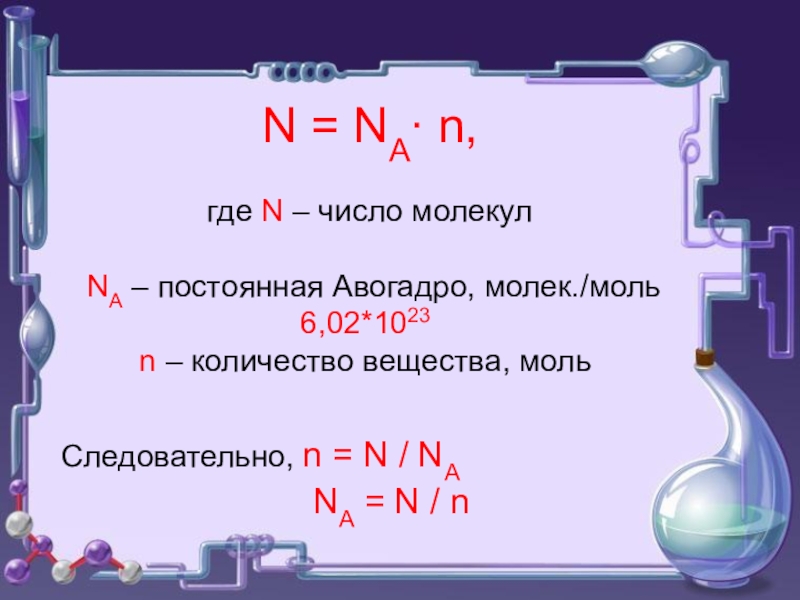
- 8. N = NA∙ n,
- 9. Некоторое представление о величине
- 10. оЗакон объемных отношенийИзмеряя объемы, и объемы газов,
- 11. Например
- 12. Закон объёмных отношений позволил итальянскому учёному А.
- 13. ооА. Авогадро1811Итальянский ученый Амадео Авогадро сформулировал закон
- 14. Следствия (для газов)Отношение массы определённого объёма одного
- 15. 1 моль любого газа при
- 16. Слайд 16
- 17. Уравнение связиГде n- количество вещества (моль)
- 18. Решение задач Найдите массу
- 19. Задачи (закрепление)Найдите массу 3 моль углекислого
Слайд 2 Количество вещества —
Под структурными единицами понимаются любые частицы,
из которых состоит вещество
(атомы, молекулы, ионы
или любые другие частицы).
Единицей измерения количества вещества в СИ служит моль.
Слайд 3
Моль – это такое количество вещества,
в котором содержится 6*10 23
(или других структурных частиц) этого вещества.
Слайд 5Молярная масса
-это масса одного моля вещества.
М=[г/моль]
( молярная масса численно равна молекулярной
отсюда
Слайд 6
[ М] – г/моль,
кг/кмоль, кг,
мг/ммоль. мг.
[ n] –моль,
кмоль,
ммоль.
Единицы измерения
Слайд 7
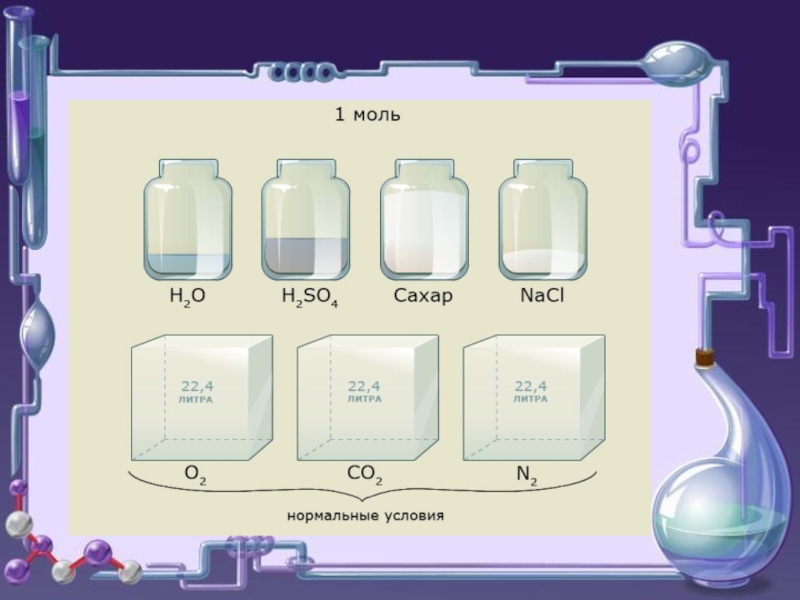
Например,
1 моль
равную 18 грамм,
так как Мr(Н2О)= 18.
Тогда: 1 моль кислорода
имеет массу - …,
5 моль алюминия - ….,
0,1 моль натрия - ….. .
Слайд 8
N = NA∙ n,
где N –
6,02*1023
n – количество вещества, моль
Следовательно, n = N / NA
NA = N / n
Слайд 9
Некоторое представление о величине числа Авогадро даёт
Количество воды, которое низвергается с ниагарского водопада (США) –
при длине 1279 м и высоте 40 м - составляет 6500 м3/с.
В капле воды содержится больше молекул, чем капель, упавших с Ниагарского водопада за 400 лет при условии постоянного полноводья.
Слайд 10о
Закон объемных отношений
Измеряя объемы, и объемы газов, в результате реакции Ж.Л.
открыл закон газовых (объемных) отношений:
Ж.Л. Гей-Люссак
1808
«При постоянном давлении и температуре объемы
вступающих в реакцию газов относятся друг к другу
как небольшие простые
целые числа»
Слайд 12Закон объёмных отношений позволил итальянскому учёному А. Авогадро предположить, что
Всего лишь восемь элементов в природе существуют в виде двухатомных молекул:
H2; N2 ; O2.
И все галогены: F2 ; Cl2 ; Br2 ; I2 ; At2.
Слайд 13о
о
А. Авогадро
1811
Итальянский ученый Амадео Авогадро сформулировал закон (для газов) :
в
Слайд 14Следствия (для газов)
Отношение массы определённого объёма одного газа к массе такого
Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
Слайд 15
1 моль любого газа при н.у. занимает
Объем 1 моль вещества – это молярный объем (Vm)
Слайд 18Решение задач
Найдите массу 2 моль кислорода.
Дано:
n (О2 )= 2 моль 1. n = m/М
2. m = n х М, М=Мr
3. М(О2 ) = 16х2=32 (г/ моль)
Найти: 4. m (О2 ) = 32х2=64 (г)
m (О2 ) - ?
Ответ: m (О2 ) = 64 г
Слайд 19
Задачи (закрепление)
Найдите массу 3 моль углекислого газа (СО2 ).
Рассчитайте массу
Что тяжелее: 2 моль СО2 или 2 моль
СаО ?
Найдите количество вещества серной кислоты (H2 SO4 ) массой 4,9 г
Какой объем займет сернистый газ (SO2 ) , масса которого равна 3,2 г?
Найдите число молекул в 2 молях
водорода.




 отсюда](/img/thumbs/4c7c4879aeebae03fd17f13746d7d6f4-800x.jpg)
![Презентация по химии на тему Количество вещества [ М] – г/моль, [ m] [ М] – г/моль, [ m] –](/img/thumbs/0afb22f36f45e50d66a5c1aae8094fea-800x.jpg)