- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Коагуляция и способы ее вызывающие
Содержание
- 1. Презентация по химии на тему Коагуляция и способы ее вызывающие
- 2. Коагуляция – физико-химический процесс слипания мелких частиц
- 3. Способы вызова коагуляции1. Высокочастотные колебания2. Повышение температуры3. Механическое воздействие4. Длительный диализ5. Прибавление электролитов
- 4. Слайд 4
- 5. Коагуляция методом прибавления электролитов1. Вводим в коллоидный
- 6. Количество электролитов, необходимое для коагуляцииМалая концентрация электролита:
- 7. Стадии коагуляцииСкрытая – Невооруженным глазом нельзя наблюдать
- 8. Слайд 8
- 9. Порог коагуляции – минимальная концентрация электролита, которая
- 10. Коагулирующий ион – тот ион электролита, который
- 11. Слайд 11
- 12. Пороги коагуляции золейРазличие в свойствах коагулирующих ионов,
- 13. Коллоидная защитаУстойчивость коллоидного раствора можно увеличить, добавляя
- 14. Механизм защитного действия сводится к образованию вокруг
- 15. СПАСИБО ЗА ВНИМАНИЕ
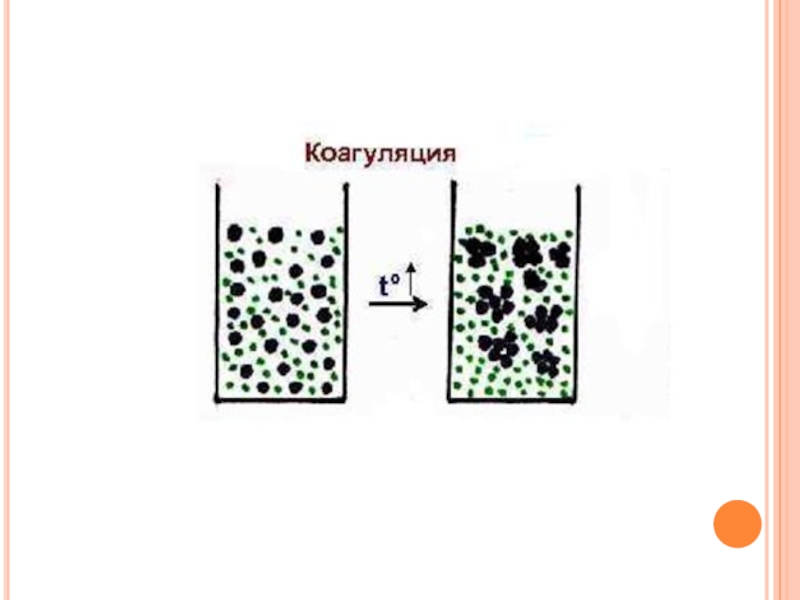
Коагуляция – физико-химический процесс слипания мелких частиц дисперсных систем в более крупные под влиянием сил сцепления с образованием коагуляционных структур.
Слайд 2 Коагуляция – физико-химический процесс слипания мелких частиц дисперсных систем в более
крупные под влиянием сил сцепления с образованием коагуляционных структур.
Слайд 3Способы вызова коагуляции
1. Высокочастотные колебания
2. Повышение температуры
3. Механическое воздействие
4. Длительный диализ
5.
Прибавление электролитов
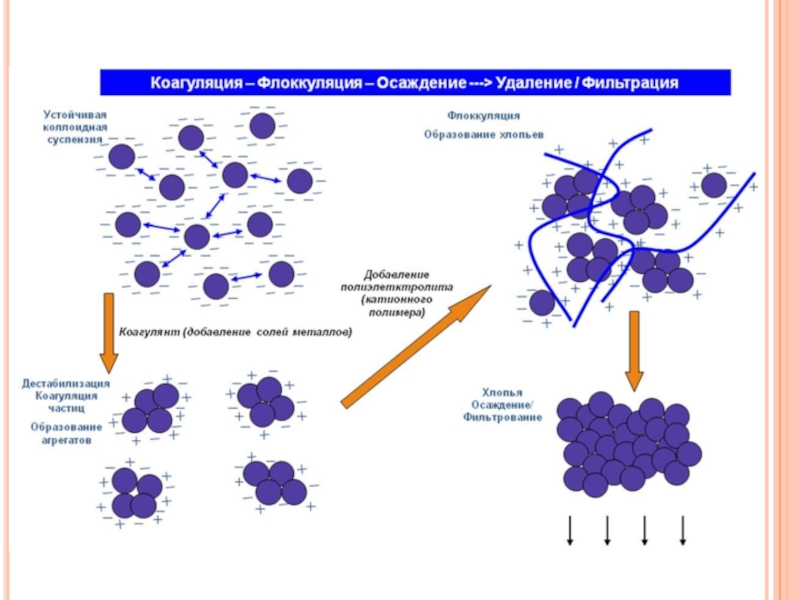
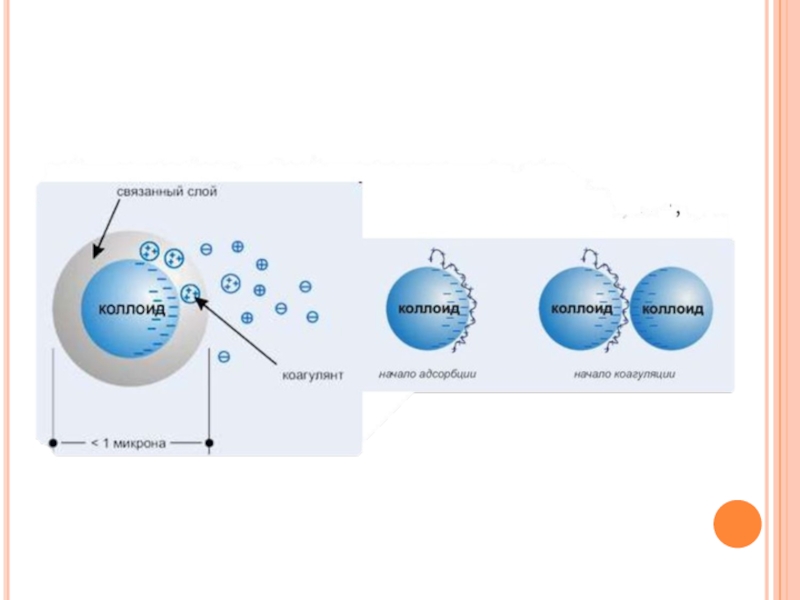
Слайд 5Коагуляция методом прибавления электролитов
1. Вводим в коллоидный раствор ионы электролита
2. Ионы
электролита дегидратируют ионы диффузного слоя, способствуют переходу их в адсорбционный слой
3. Происходит сжатие диффузного слоя и уменьшение сил электрического отталкивания
4. Силы межмолекулярного сцепления растут, что способствует слипанию и укрупнению частиц
3. Происходит сжатие диффузного слоя и уменьшение сил электрического отталкивания
4. Силы межмолекулярного сцепления растут, что способствует слипанию и укрупнению частиц
Слайд 6Количество электролитов, необходимое для коагуляции
Малая концентрация электролита: наступает только начальная стадия
коагуляции, слипание частиц происходит незначительно (скрытая коагуляция)
Увеличение концентрации электролита: дальнейшее развитие коагуляции, повышение ее скорости и появление более крупных частиц (явная коагуляция)
Увеличение концентрации электролита: дальнейшее развитие коагуляции, повышение ее скорости и появление более крупных частиц (явная коагуляция)
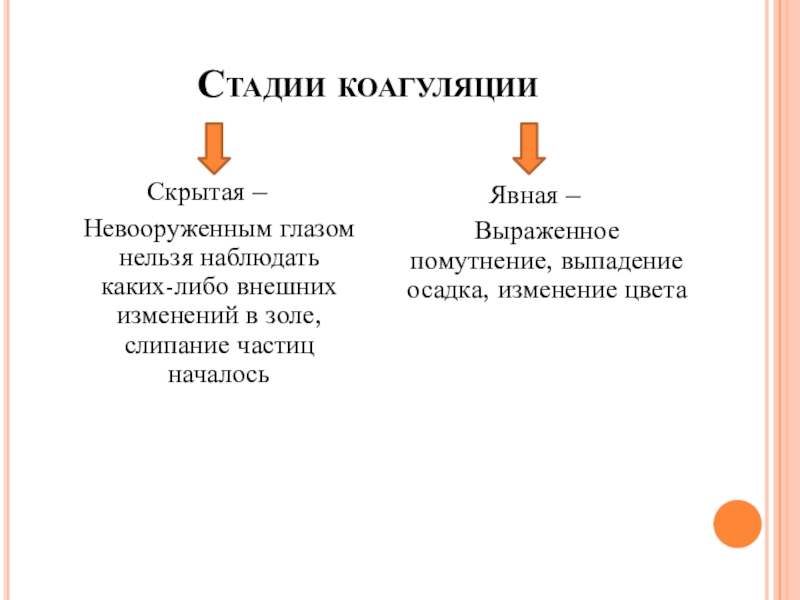
Слайд 7Стадии коагуляции
Скрытая –
Невооруженным глазом нельзя наблюдать каких-либо внешних изменений в
золе, слипание частиц началось
Явная –
Выраженное помутнение, выпадение осадка, изменение цвета
Слайд 9Порог коагуляции – минимальная концентрация электролита, которая вызывает начало явной коагуляции.
у золей порог коагуляции обычно невелик и выражается в долях миллимолей электролита на литр золя
Коагулирующая способность электролитов (ионов) неодинакова и может быть определена как величина, обратная порогу коагуляции:
КС = 1
ПК
Коагулирующая способность электролитов (ионов) неодинакова и может быть определена как величина, обратная порогу коагуляции:
КС = 1
ПК
Слайд 10Коагулирующий ион – тот ион электролита, который несет заряд, противоположный заряду
коллоидной частицы.
Правило Шульце-Гарди:
Чем выше заряд коагулирующего иона, тем больше выражена его коагуляционная способность и тем ниже порог коагуляции.
Действие коагулирующих ионов во много раз усиливается с повышением их валентности.
Правило Шульце-Гарди:
Чем выше заряд коагулирующего иона, тем больше выражена его коагуляционная способность и тем ниже порог коагуляции.
Действие коагулирующих ионов во много раз усиливается с повышением их валентности.
Слайд 12Пороги коагуляции золей
Различие в свойствах коагулирующих ионов, обусловленное их размерами и
степенью гидратации, мало сказывается на значении порогов коагуляции.
Слайд 13Коллоидная защита
Устойчивость коллоидного раствора можно увеличить, добавляя к нему небольшое количество
раствора высокомолекулярного вещества.
Пример:
Красный золь золота быстро коагулирует от прибавления небольшого количества электролита. Если же к золю золота предварительно добавить небольшое количество раствора желатина, то устойчивость золя к действию коагулирующих ионов резко возрастает. Чтобы вызвать коагуляцию такого защищенного золя золота, требуется значительное количество электролита.
Пример:
Красный золь золота быстро коагулирует от прибавления небольшого количества электролита. Если же к золю золота предварительно добавить небольшое количество раствора желатина, то устойчивость золя к действию коагулирующих ионов резко возрастает. Чтобы вызвать коагуляцию такого защищенного золя золота, требуется значительное количество электролита.
Слайд 14Механизм защитного действия сводится к образованию вокруг коллоидной частицы адсорбционной оболочки
из высокомолекулярного вещества. Макромолекулы полимера, адсорбируясь на поверхности мицеллы, образуют прочную оболочку, препятствующую слипанию коллоидных частиц.