- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислоты 8класс
Содержание
- 1. Презентация по химии на тему Кислоты 8класс
- 2. ЦельСформировать понятие о кислотах как классе электролитов;Рассмотреть
- 3. Что такое кислоты?Сложные вещества, состоящие из атомов
- 4. Классификация кислот
- 5. Химические свойства кислотДиссоциация;Взаимодействие с индикаторами;Взаимодействие с металлами;Взаимодействие с основными оксидами;Взаимодействие с основаниями;Взаимодействие с солями.
- 6. Диссоциация кислотHCl →HNO3→H2SO4 →H3PO4 → НnКост →
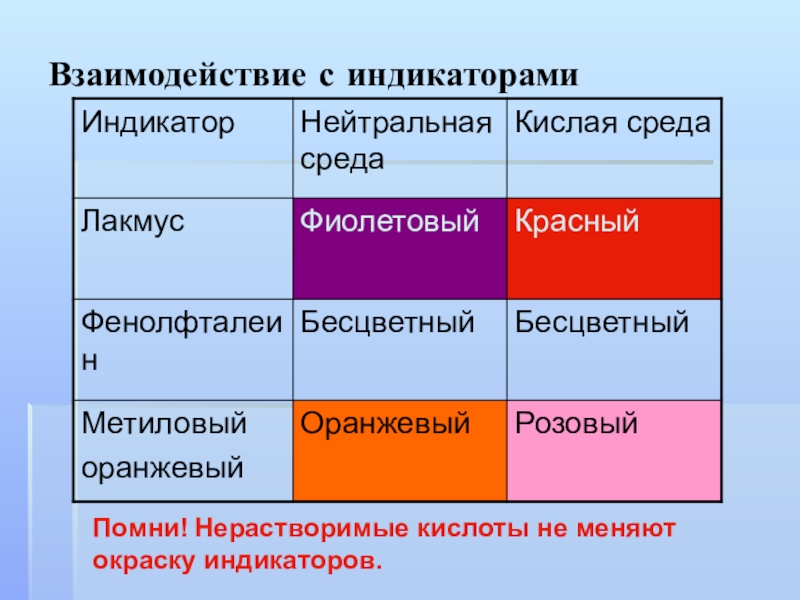
- 7. Взаимодействие с индикаторамиПомни! Нерастворимые кислоты не меняют окраску индикаторов.
- 8. Взаимодействие с металламиМе + НnКост → МеnКостm+
- 9. Взаимодействие с основными оксидамиМеxOy + HnКост →
- 10. Взаимодействие с основаниямиМе(ОН)m + НnКост → MenКостm
- 11. Взаимодействие с солями МеxКостy + HnКост →
- 12. Д/З ! Прочитать § 38 Выполнить задание №3 письменно.Повторить материал об основаниях
Слайд 2Цель
Сформировать понятие о кислотах как классе электролитов;
Рассмотреть их классификацию по разным
Представить химические свойства кислот в свете теории электролитической диссоциации.
Слайд 3Что такое кислоты?
Сложные вещества, состоящие из атомов водорода, соединенных с кислотным
Электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка
Слайд 5Химические свойства кислот
Диссоциация;
Взаимодействие с индикаторами;
Взаимодействие с металлами;
Взаимодействие с основными оксидами;
Взаимодействие с
Взаимодействие с солями.
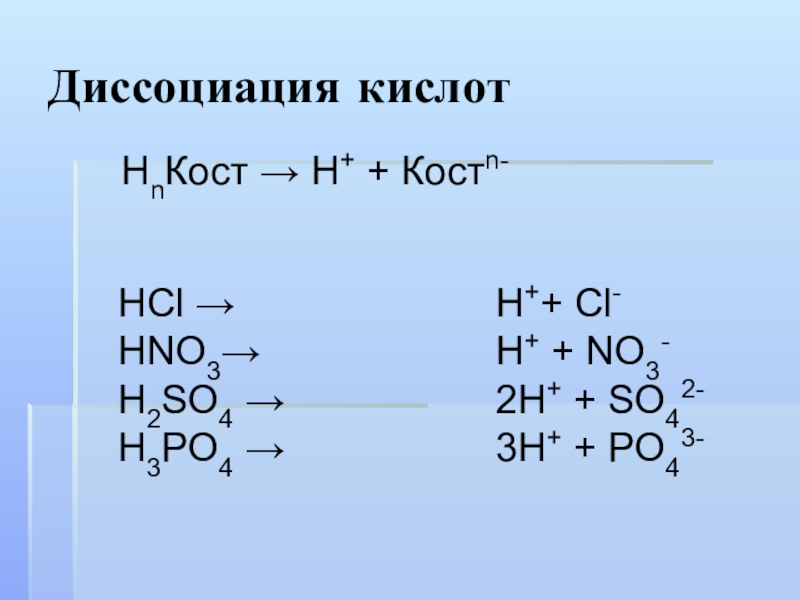
Слайд 6Диссоциация кислот
HCl →
HNO3→
H2SO4 →
H3PO4 →
НnКост → Н+ + Костn-
H++ Cl-
H+
2H+ + SO42-
3H+ + PO43-
Слайд 8Взаимодействие с металлами
Ме + НnКост → МеnКостm+ Н2
металл + кислота→соль +
2
Al +
3
H2SO4 →
3
H2
Реакция возможна, если:
Металл находится в ряду активности до водорода;
В результате реакции получается растворимая соль;
Кислота растворима
Al2(SO4)3 +
Слайд 9Взаимодействие с основными оксидами
МеxOy + HnКост → МеnКостy + H2O
Основный оксид
Реакция возможна, если в результате получается растворимая соль
MgO +
2
HCl →
MgCl2 + H2O
MgO + 2H+ + 2Cl- → Mg2+ + 2Cl- + H2O
MgO + 2H+ → Mg2+ + H2O
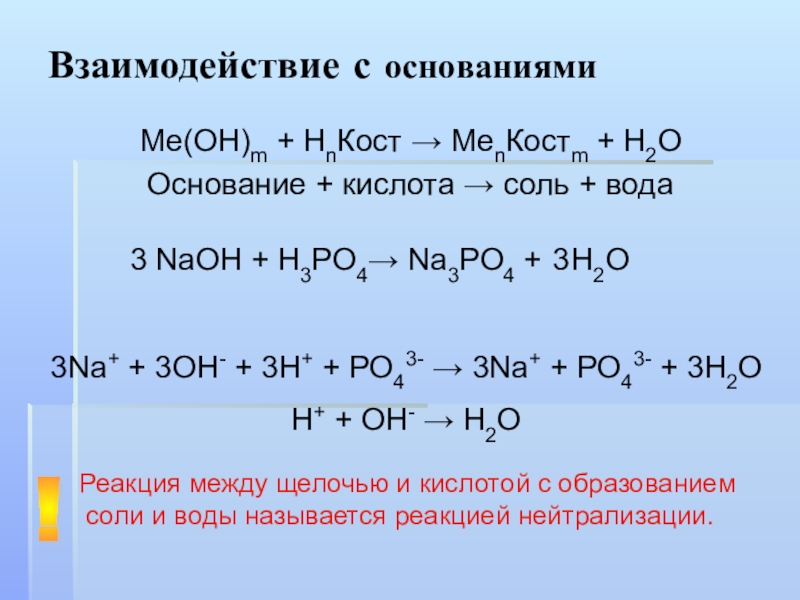
Слайд 10Взаимодействие с основаниями
Ме(ОН)m + НnКост → MenКостm + H2O
Основание + кислота
NaOH + H3PO4→
Na3PO4 +
3
H2O
3
3Na+ + 3OH- + 3H+ + PO43- → 3Na+ + PO43- + 3H2O
H+ + OH- → H2O
Реакция между щелочью и кислотой с образованием соли и воды называется реакцией нейтрализации.
!
Слайд 11Взаимодействие с солями
МеxКостy + HnКост → HхКост + МеnКостy
Соль +
Li2CO3 +
H3PO4 →
Li3PO4 +
H2O +
CO2
3
2
2
3
3
6Li+ + 3CO32- + 6H+ + PO43- → 6Li+ + 2PO43- + 3H2O + 3CO2
2H+ + CO32- → H2O + CO2
Реакция возможна, если в результате образуется осадок, газ или слабый электролит