Иевлева И.Ф., учитель химии
МБОУ Гимназия № 44 г. Иркутска
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислоты. Обобщение (8 класс)
Содержание
- 1. Презентация по химии на тему Кислоты. Обобщение (8 класс)
- 2. Кислоты - сложные вещества, состоящие из атомовводорода и кислотных остатков.HxAcAc – кислотный остаток Общая формула:+-Х
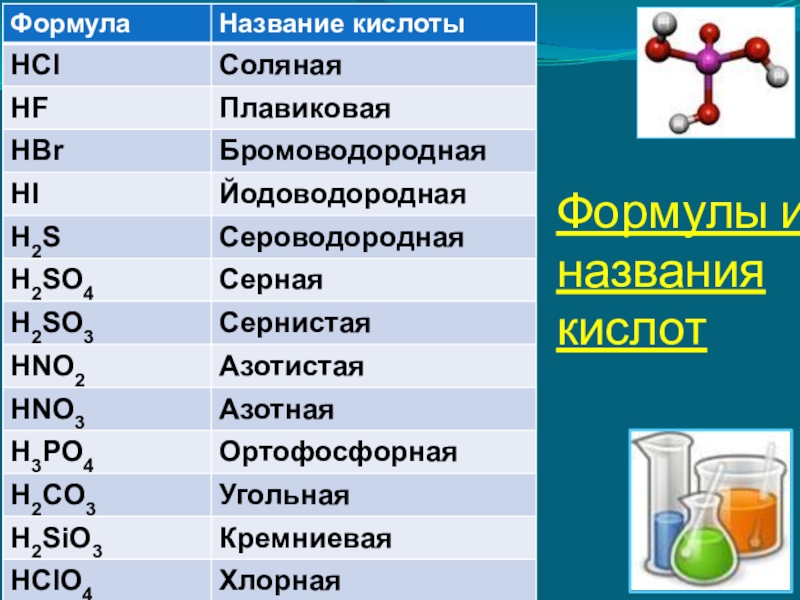
- 3. Формулы и названия кислот
- 4. Классифицировать кислотыHFБескислородная,одноосновнаяH3PO4Кислородосодержая, трехосновнаяHNO3Кислородосодержая, одноосновнаяH2SБескислородная, двухосновная
- 5. Номенклатура кислотБескислородные корень русского название элемента + О + водородная
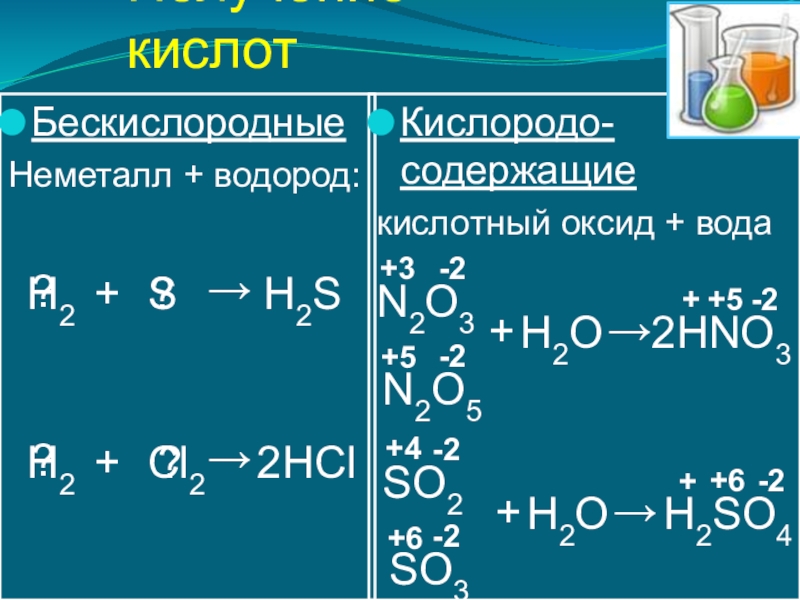
- 6. Получение кислотБескислородныеНеметалл + водород:Кислородо-содержащиекислотный оксид + водаH2SНNO3 H2→+S??HClH2→+Cl2??2→N2O5H2O+N2O3+-2+5-2-2+3+52Н2SO4 →SO3H2O+SO2+-2+6-2-2+4+6
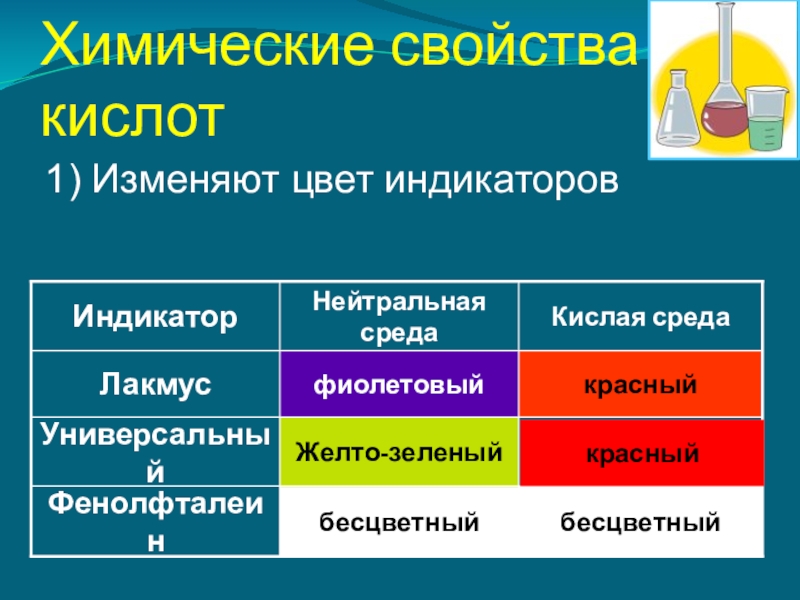
- 7. Химические свойства кислот1) Изменяют цвет индикаторовбесцветныйбесцветныйФенолфталеинЖелто-зеленыйУниверсальныйкрасныйфиолетовыйЛакмусКислая средаНейтральная средаИндикаторкрасный
- 8. 2) Взаимодействие с металламиMe … ] HZn
- 9. ZnO + HCl →3) Взаимодействие
- 10. 4) Взаимодействие с основаниями и амфотерными гидроксдами Соли
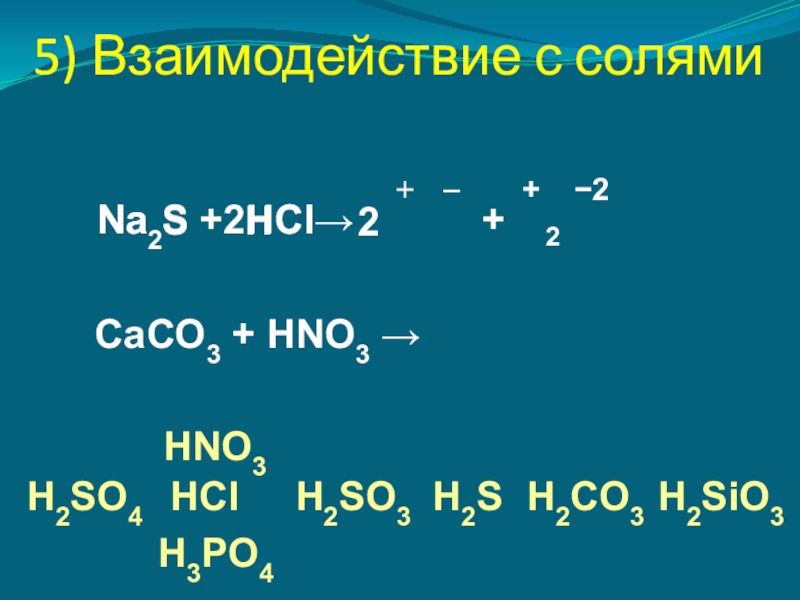
- 11. 5) Взаимодействие с солямиNa2S + HCl→NaCl+HSCaСO3 + HNO3 →H2SO4HNO3HClH3PO4H2SO3H2SH2SiO3H2CO3+−2222+−
- 12. 5) РазложениеH2SO3 →SO2 + H2O+−2+4+4−2H2CO3 →H3PO4 →
- 13. Домашнее задание§ 32 С.104 №8
Кислоты - сложные вещества, состоящие из атомовводорода и кислотных остатков.HxAcAc – кислотный остаток Общая формула:+-Х
Слайд 18 класс, общеобразовательный
МБОУ Гимназия № 44 г. Иркутска
Кислоты
Обобщение сведений о классах
неорганических соединений
Слайд 2Кислоты -
сложные вещества, состоящие из атомов
водорода и кислотных остатков.
HxAc
Ac –
кислотный остаток
Общая формула:
+
-Х
Слайд 4Классифицировать
кислоты
HF
Бескислородная,
одноосновная
H3PO4
Кислородосодержая, трехосновная
HNO3
Кислородосодержая, одноосновная
H2S
Бескислородная, двухосновная
Слайд 5Номенклатура кислот
Бескислородные
корень русского название элемента +
О +
водородная кислота
H2S – сероводородная
Кислородо-содержащие
корень русского
название
элемента +
н, нист, ист, ов
НNO3 - азотная
н, нист, ист, ов
НNO3 - азотная
Слайд 6Получение кислот
Бескислородные
Неметалл + водород:
Кислородо-содержащие
кислотный оксид + вода
H2S
НNO3
H2
→
+
S
?
?
HCl
H2
→
+
Cl2
?
?
2
→
N2O5
H2O
+
N2O3
+
-2
+5
-2
-2
+3
+5
2
Н2SO4
→
SO3
H2O
+
SO2
+
-2
+6
-2
-2
+4
+6
Слайд 7Химические свойства
кислот
1) Изменяют цвет индикаторов
бесцветный
бесцветный
Фенолфталеин
Желто-зеленый
Универсальный
красный
фиолетовый
Лакмус
Кислая среда
Нейтральная среда
Индикатор
красный
Слайд 9ZnO + HCl →
3) Взаимодействие с основными и амфотерными
оксидами
Zn
Cl
+2
−
2
H
O
+
−2
+
2
2
CaO + HNO3 →
Соли – сложные вещества, состоящие из катионов металлов и анионов кислотных остатков.
Слайд 104) Взаимодействие с основаниями и амфотерными гидроксдами
Соли – сложные вещества, состоящие
из катионов металлов и анионов кислотных остатков.
NaOH + HCl →
Na
Cl
+
H
OH
H2O
Ca(OH)2 + HNO3 →
+
−




![Презентация по химии на тему Кислоты. Обобщение (8 класс) 2) Взаимодействие с металламиMe … ] HZn + HCl →ZnCl +2−2+ H2Al + H3PO4 → 2 2) Взаимодействие с металламиMe … ] HZn + HCl →ZnCl +2−2+ H2Al + H3PO4 →](/img/thumbs/255bfe8fc395ad0dca4a6377f7ff024c-800x.jpg)