- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислород(9 класс)
Содержание
- 1. Презентация по химии на тему Кислород(9 класс)
- 2. Кислород - самый распространенный на Земле химический
- 3. В периодической системе кислород расположен в VI
- 4. Кислород О2
- 5. В 1774 году английский ученый Джозеф Пристли
- 6. Получение кислородаВ лаборатории:1. Разложением перманганата калия при
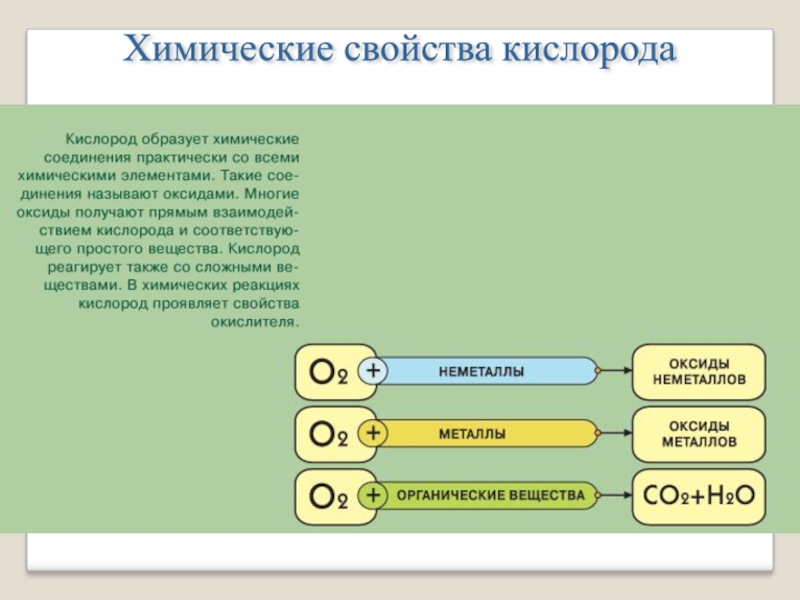
- 7. Химические свойства кислорода
- 8. 1- С неметаллами. При нагревании кислород взаимодействует
- 9. 2- С металлами. Очень активно взаимодействуют с
- 10. 3- В кислороде горят также сложные вещества
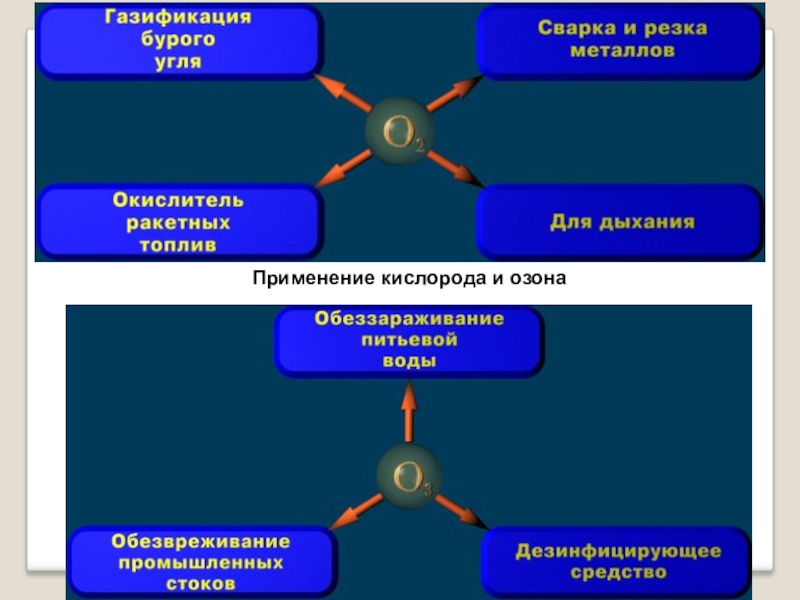
- 11. Применение кислорода и озона
- 12. Природа и состав воздуха – вещества, необходимого
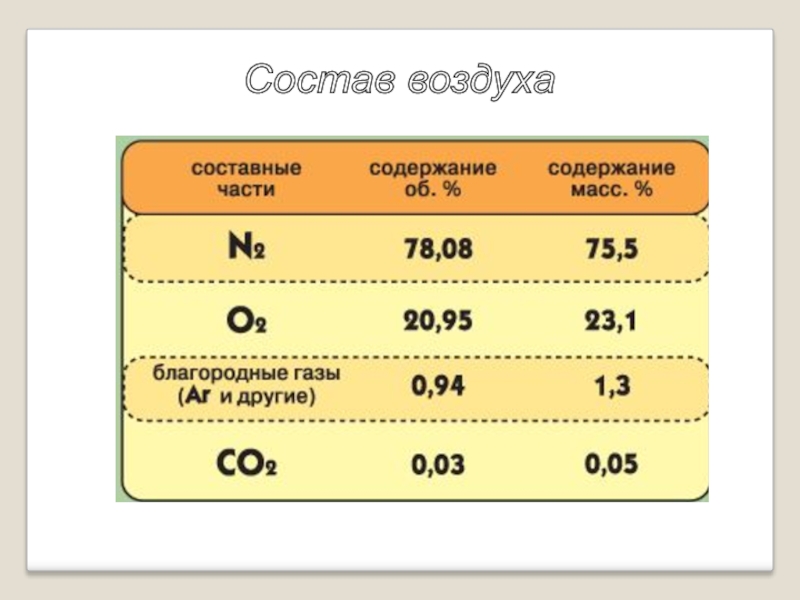
- 13. Состав воздуха
Кислород - самый распространенный на Земле химический элемент. Массовая доля кислорода в земной коре примерно 49%. Кислород встречается в природе в свободном (составная часть воздуха) и в связанном состоянии (вода, различные минералы, растения и животные).
Слайд 2Кислород - самый распространенный на Земле химический элемент. Массовая доля кислорода
в земной коре примерно 49%. Кислород встречается в природе в свободном (составная часть воздуха) и в связанном состоянии (вода, различные минералы, растения и животные).
Слайд 3В периодической системе кислород расположен в VI группе второго периода.
Атом
кислорода содержит 8 электронов: 2 электрона на 1s2 -орбитали и 6 - на внешнем слое ( электронная конфигурация 1s22s22р4). Только фтор может окислить кислород, образуя дифторид кислорода OF2. Во всех остальных соединениях степень окисления кислорода -2. Важная особенность строения молекулы
O2 - наличие двух неспаренных электронов, что приводит к эффекту парамагнетизма, т. е. свойству молекул ориентироваться в направлении магнитного поля.
Атомы кислорода образуют двухатомную молекулу с двойной связью. В обычных условиях молекулы кислорода устойчивы и на атомы не распадаются, поэтому молекулярный кислород высокой активностью не отличается.
Атомы кислорода образуют двухатомную молекулу с двойной связью. В обычных условиях молекулы кислорода устойчивы и на атомы не распадаются, поэтому молекулярный кислород высокой активностью не отличается.
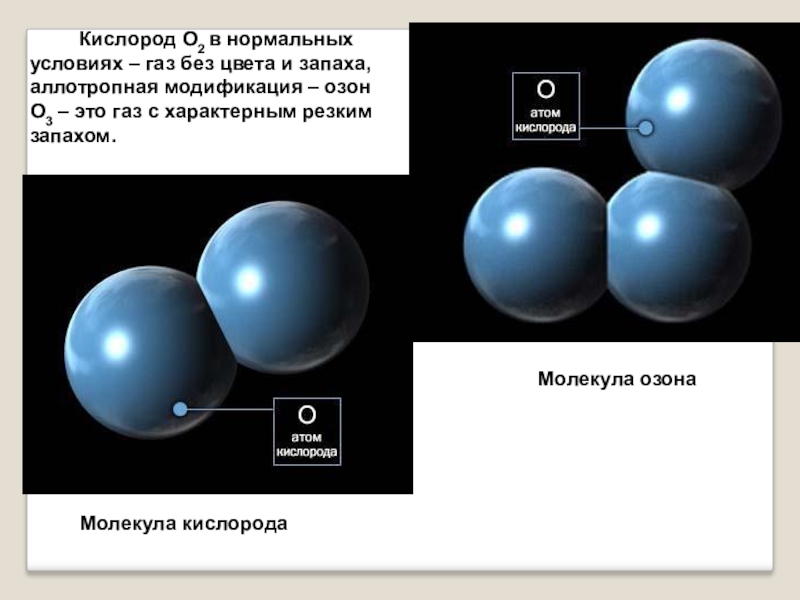
Слайд 4 Кислород О2 в нормальных условиях –
газ без цвета и запаха, аллотропная модификация – озон О3 – это газ с характерным резким запахом.
Молекула кислорода
Молекула озона
Слайд 5В 1774 году английский ученый Джозеф Пристли открыл кислород. Он нагрел
оксид ртути (II) – соединение ртути и кислорода – и собрал выделившийся газ. К своему удивлению он обнаружил, что свеча, помещенная в этот газ, горит ярче.
Сейчас кислород получают в лаборатории разложением менее токсичных веществ.
Сейчас кислород получают в лаборатории разложением менее токсичных веществ.
Слайд 6Получение кислорода
В лаборатории:
1. Разложением перманганата калия при нагревании:
2KMnO4 = K2MnO4 +
MnO2 + O2
Также в аналогичных реакциях разложения используют сурик Pb3O4, оксид ртути HgO, бертолетову соль КСlO3.
2. Разложением пероксида водорода:
2H2O2 = 2H2O + O2
В природе кислород образуется в результате процесса фотосинтеза:
6CO2 + 6H2O = C6H12O6 + 6O2
В промышленности:
1. Сжижением воздуха с помощью холодильных машин, далее, используя различие температур кипения кислорода (– 183°C) и азота (– 196°C), выделяют кислород.
2. Чистый кислород получают электролизом воды. Это очень дорогой метод и поэтому мало распространен.
2H2O = 2H2 + O2
Также в аналогичных реакциях разложения используют сурик Pb3O4, оксид ртути HgO, бертолетову соль КСlO3.
2. Разложением пероксида водорода:
2H2O2 = 2H2O + O2
В природе кислород образуется в результате процесса фотосинтеза:
6CO2 + 6H2O = C6H12O6 + 6O2
В промышленности:
1. Сжижением воздуха с помощью холодильных машин, далее, используя различие температур кипения кислорода (– 183°C) и азота (– 196°C), выделяют кислород.
2. Чистый кислород получают электролизом воды. Это очень дорогой метод и поэтому мало распространен.
2H2O = 2H2 + O2
Слайд 81- С неметаллами.
При нагревании кислород взаимодействует с водородом, серой, углеродом,
фосфором, образуя воду и оксиды:
2Н2 + О2 = 2Н2О С + O2 = СO2
S + O2 = SO2 4Р + 5О2 = 2Р2О5
С галогенами кислород в реакцию не вступает.
2Н2 + О2 = 2Н2О С + O2 = СO2
S + O2 = SO2 4Р + 5О2 = 2Р2О5
С галогенами кислород в реакцию не вступает.
Слайд 92- С металлами.
Очень активно взаимодействуют с кислородом щелочные и щелочноземельные
металлы с образованием оксидов и пероксидов:
4К + О2 = 2К2О ( KO2) Ba + O2 = BaO2
С остальными металлами кислород реагирует при нагревании, выделяя большое количество теплоты и света:
2Mg + O2 = 2MgO
При повышении температуры окисление ускоряется. Например, в нормальных условиях железо окисляется довольно медленно, а при температуре красного каления ( ~400°C) железные стружки сгорают в кислороде:
3Fe + 2O2 = Fe3O4
4К + О2 = 2К2О ( KO2) Ba + O2 = BaO2
С остальными металлами кислород реагирует при нагревании, выделяя большое количество теплоты и света:
2Mg + O2 = 2MgO
При повышении температуры окисление ускоряется. Например, в нормальных условиях железо окисляется довольно медленно, а при температуре красного каления ( ~400°C) железные стружки сгорают в кислороде:
3Fe + 2O2 = Fe3O4
Слайд 103- В кислороде горят также сложные вещества с образованием соответствующих оксидов:
CH4 + 2O2 = CO2 + 2H2O
Слайд 12Природа и состав воздуха – вещества, необходимого практически для всех живых
организмов, – были объектом исследований в течение многих веков. В давние времена люди верили, что воздух – один из четырех элементов наряду с водой, землей и огнем.
До 18 века ученые-естествоиспытатели считали, что все образующиеся в каких-либо реакциях газы являются воздухом, но с особыми свойствами. Лишь в конце 18 века исследователи Дж. Пристли, А. Лавуазье и К. Шееле установили, что воздух – это смесь газов, из которых наиболее важными являются кислород и азот.
До 18 века ученые-естествоиспытатели считали, что все образующиеся в каких-либо реакциях газы являются воздухом, но с особыми свойствами. Лишь в конце 18 века исследователи Дж. Пристли, А. Лавуазье и К. Шееле установили, что воздух – это смесь газов, из которых наиболее важными являются кислород и азот.
Д.Пристли
А. Лавуазье
К. Шееле