- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислород и сера (9 класс)
Содержание
- 1. Презентация по химии на тему Кислород и сера (9 класс)
- 2. ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕКИСЛОРОД и СЕРА элементы
- 3. СТРОЕНИЕ АТОМА КИСЛОРОДА Электронные конфигурации атома:
- 4. АЛЛОТРОПИЯ КИСЛОРОДА Два аллотропных видоизменения химического элемента
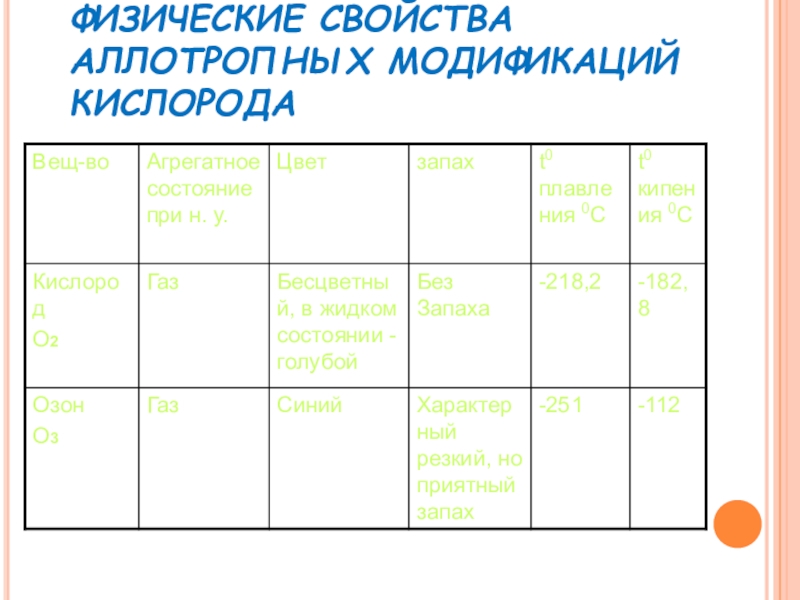
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА АЛЛОТРОПНЫХ МОДИФИКАЦИЙ КИСЛОРОДА
- 6. Озон химически активнее кислорода: Активность
- 7. Получение озона
- 8. ПОЛУЧЕНИЕ КИСЛОРОДА Кислород (O2) в лаборатории получают
- 9. В лаборатории кислород можно так же получать
- 10. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДАКислород непосредственно реагирует со всеми
- 11. ВЗАИМОДЕЙСТВИЕ С АКТИВНЫМИ МЕТАЛЛАМИ Горение магния2Mg + O2= 2MgO
- 12. ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ НЕМЕТАЛЛАМИГорение серы в кислороде S + O2= SO2
- 13. Горение углерода в кислороде С+О2= СО2 Горение фосфора в кислороде 4P + 5O2 = 2P2O5
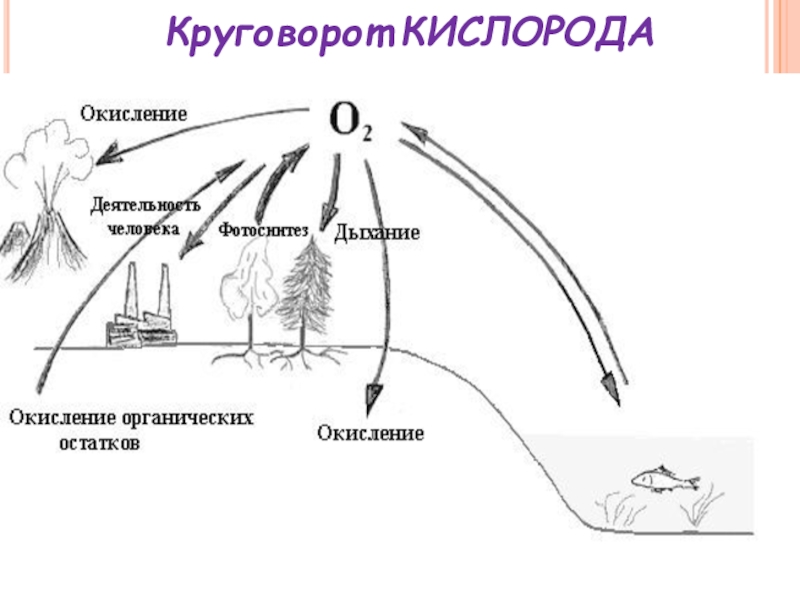
- 14. Круговорот КИСЛОРОДА
- 15. ПРИМЕНЕНИЕ КИСЛОРОДАВ химической промышленностиВ производстве взрывчатых смесейПри
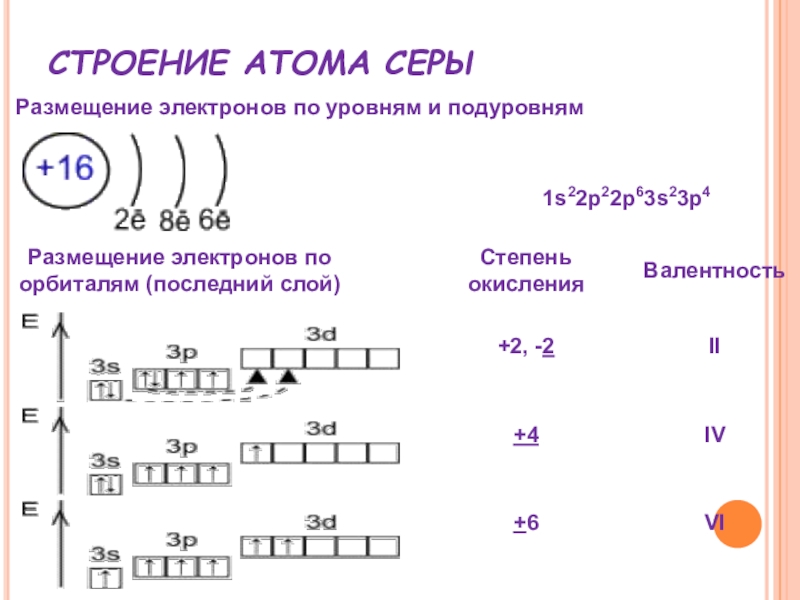
- 16. СТРОЕНИЕ АТОМА СЕРЫ Размещение электронов по уровням и подуровням
- 17. АЛЛОТРОПИЯ СЕРЫ1) ромбическая (α - сера) -
- 18. ПОЛУЧЕНИЕ СЕРЫ 1. Промышленный метод - выплавление из
- 19. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ Окислительные свойства серы (S0
- 20. Восстановительные свойства сера проявляет в реакциях с
- 21. РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ (СЕРА ВЫСТУПАЕТ КАК ОКИСЛИТЕЛЬ И
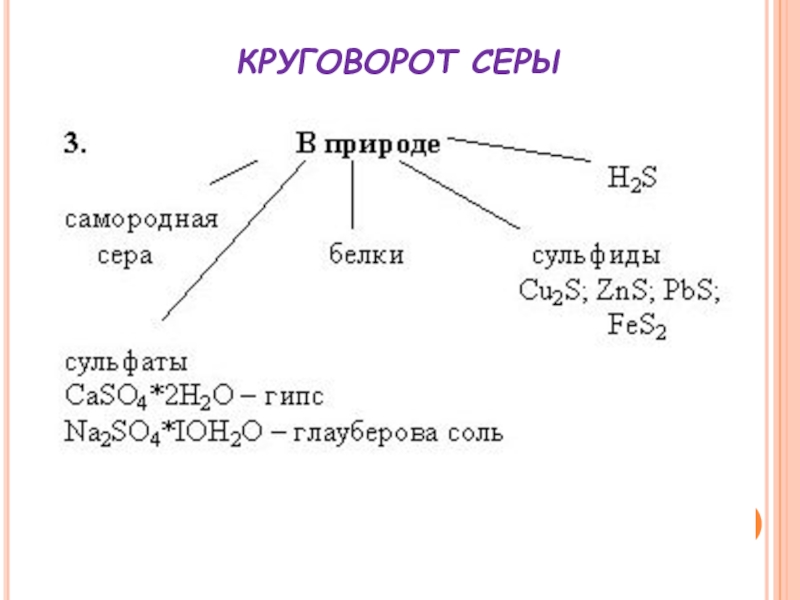
- 22. КРУГОВОРОТ СЕРЫ
- 23. ПРИМЕНЕНИЕ СЕРЫ Вулканизация каучука Получение эбонитаПроизводство спичек, порохаВ
- 24. Слайд 24
- 25. СПАСИБО ЗА ВНИМАНИЕ
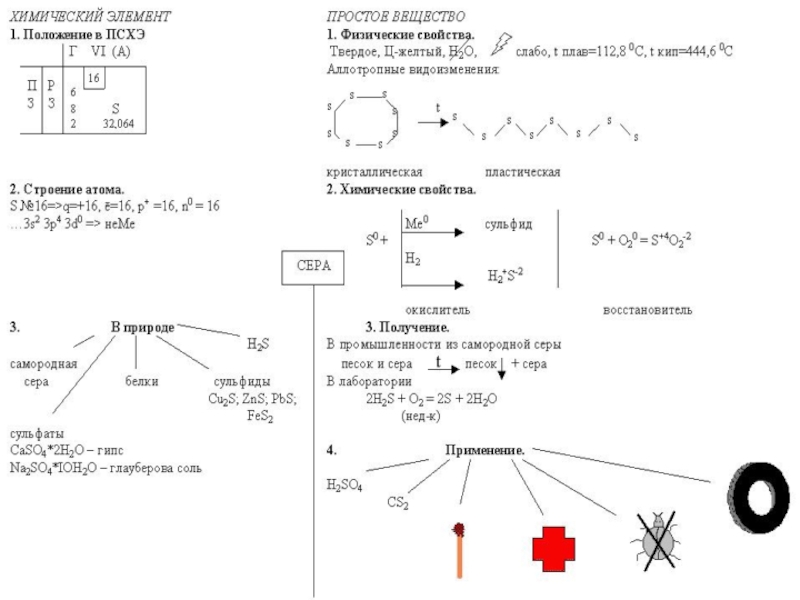
ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕКИСЛОРОД и СЕРА элементы VIA группы периодической системы Элементы этой группы имеют общее название - ХАЛЬКОГЕНЫ, что означает «рождающие руды»
Слайд 2ПОЛОЖЕНИЕ В ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
КИСЛОРОД и СЕРА
элементы VIA группы периодической
системы
Элементы этой группы имеют общее название - ХАЛЬКОГЕНЫ, что означает «рождающие руды»
Элементы этой группы имеют общее название - ХАЛЬКОГЕНЫ, что означает «рождающие руды»
Слайд 3СТРОЕНИЕ АТОМА КИСЛОРОДА
Электронные конфигурации атома:
Степени окисления КИСЛОРОДА:
-2, 0, +2
Валентность
кислорода
равна двум (может быть 3 и 4 с учётом донорно-акцепторных
связей)
Слайд 4АЛЛОТРОПИЯ КИСЛОРОДА
Два аллотропных видоизменения химического элемента кислорода:
кислород О2
озон О3
Слайд 6
Озон химически активнее кислорода:
Активность озона объясняется тем, что при
его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами.
O3=>O2+O
Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании:
Но в то же время и озон и кислород реагируют с активными металлами.
O3=>O2+O
Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании:
Но в то же время и озон и кислород реагируют с активными металлами.
Слайд 7Получение озона Реакция идет с поглощением энергии при прохождении электрического
разряда через кислород, например во время грозы, при сверкании молнии. Обратная реакция происходит при обычных условиях, так как озон — неустойчивое вещество. В природе озон разрушается под действием газов, выбрасываемых в атмосферу, например фреонов, в процессе техногенной деятельности человека.
Результатом является образование так называемых озоновых дыр, т. е. разрывов в тончайшем слое, состоящем из молекул озона.
Слайд 8ПОЛУЧЕНИЕ КИСЛОРОДА
Кислород (O2) в лаборатории получают разложением перманганата калия KMnO4
(марганцовки).
2KMnO4 = K2MnO4 + MnO2 + O2 ↑
2KMnO4 = K2MnO4 + MnO2 + O2 ↑
Слайд 9В лаборатории кислород можно так же получать разложением других солей при
нагревании
2KNO3=>2KNO2+O2
2KClO3=>2KCl+3O2
В промышленности кислород получают из жидкого воздуха (при охлаждении до to
-283Co) или в результате электролиза воды
2H2O= 2H2+O2
В природе кислород образуется в процессе фотосинтеза
6CO2+6H2O=> C6H12O6+6O2 ↑
2KNO3=>2KNO2+O2
2KClO3=>2KCl+3O2
В промышленности кислород получают из жидкого воздуха (при охлаждении до to
-283Co) или в результате электролиза воды
2H2O= 2H2+O2
В природе кислород образуется в процессе фотосинтеза
6CO2+6H2O=> C6H12O6+6O2 ↑
Слайд 10ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
Кислород непосредственно реагирует со всеми простыми веществами, кроме золота,
платины и галогенов.
В кислороде могут гореть даже те вещества, которые не горят на воздухе.
3Fe+2O2=Fe3O4 (железная окалина)
Слайд 15ПРИМЕНЕНИЕ КИСЛОРОДА
В химической промышленности
В производстве взрывчатых смесей
При сварке и резке металлов
В
космической технике (ракетное топливо)
В металлургической промышленности
В дыхательных смесях
В медицине
В металлургической промышленности
В дыхательных смесях
В медицине
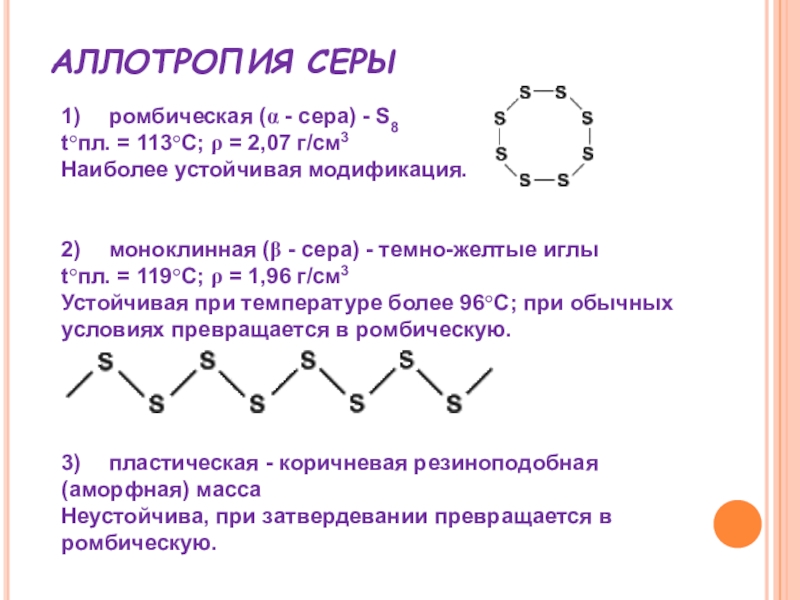
Слайд 17АЛЛОТРОПИЯ СЕРЫ
1) ромбическая (α - сера) - S8
t°пл. = 113°C; ρ
= 2,07 г/см3
Наиболее устойчивая модификация.
2) моноклинная (β - сера) - темно-желтые иглы
t°пл. = 119°C; ρ = 1,96 г/см3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая - коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую.
Наиболее устойчивая модификация.
2) моноклинная (β - сера) - темно-желтые иглы
t°пл. = 119°C; ρ = 1,96 г/см3
Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
3) пластическая - коричневая резиноподобная (аморфная) масса
Неустойчива, при затвердевании превращается в ромбическую.
Слайд 18ПОЛУЧЕНИЕ СЕРЫ
1. Промышленный метод - выплавление из руды с помощью водяного
пара.
2. Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 => 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 => 3S + 2H2O
2. Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 => 2S + 2H2O
3. Реакция Вакенродера
2H2S + SO2 => 3S + 2H2O
Слайд 19ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ
Окислительные свойства серы
(S0 + 2ē => S-2)
1) Сера реагирует
со щелочными металлами без нагревания:
2Na + S => Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t°:
2Al + 3S =t°=> Al2S3
Zn + S =t°=> ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S => H2S
2P + 3S => P2S3
C + 2S => CS2
2Na + S => Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t°:
2Al + 3S =t°=> Al2S3
Zn + S =t°=> ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S => H2S
2P + 3S => P2S3
C + 2S => CS2
Слайд 20Восстановительные свойства сера проявляет в реакциях с сильными окислителями: (S0 - 2ē
=> S+2; S0- 4ē => S+4; S0 - 6ē => S+6)
3) c кислородом:
S + O2 =t°=> S+4O2
2S + 3O2 =t°pt=> 2S+6O3
4) c галогенами (кроме йода):
S + Cl2 => S+2Cl2
5) c кислотами - окислителями:
S + 2H2SO4(конц) => 3S+4O2 + 2H2O
S + 6HNO3(конц) => H2S+6O4 + 6NO2 + 2H2O
3) c кислородом:
S + O2 =t°=> S+4O2
2S + 3O2 =t°pt=> 2S+6O3
4) c галогенами (кроме йода):
S + Cl2 => S+2Cl2
5) c кислотами - окислителями:
S + 2H2SO4(конц) => 3S+4O2 + 2H2O
S + 6HNO3(конц) => H2S+6O4 + 6NO2 + 2H2O
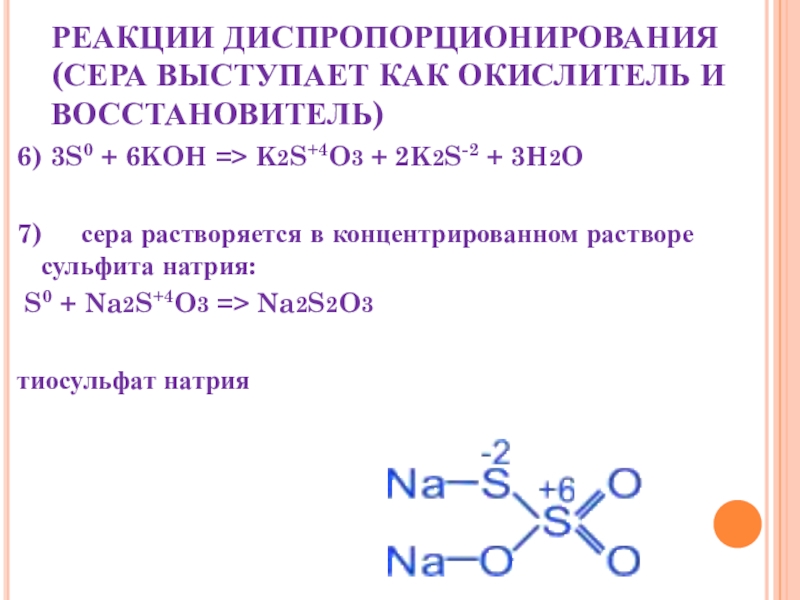
Слайд 21РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ (СЕРА ВЫСТУПАЕТ КАК ОКИСЛИТЕЛЬ И ВОССТАНОВИТЕЛЬ)
6) 3S0 + 6KOH
=> K2S+4O3 + 2K2S-2 + 3H2O
7) сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 => Na2S2O3
тиосульфат натрия
7) сера растворяется в концентрированном растворе сульфита натрия:
S0 + Na2S+4O3 => Na2S2O3
тиосульфат натрия
Слайд 23ПРИМЕНЕНИЕ СЕРЫ
Вулканизация каучука
Получение эбонита
Производство спичек, пороха
В борьбе с вредителями сельского
хозяйства
Для медицинских целей (серные мази для лечения кожных заболеваний)
Для получения серной кислоты
Для медицинских целей (серные мази для лечения кожных заболеваний)
Для получения серной кислоты