- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Карбоновые кислоты
Содержание
- 1. Презентация по химии на тему Карбоновые кислоты
- 2. Карбоновые кислоты – это вещества, содержащие в
- 3. Классификация карбоновых кислот1. В зависимости от числа
- 4. 2. В зависимости от природы углеводородного радикала
- 5. Номенклатура карбоновых кислотНазвание карбоновой кислоты образуется от
- 6. Изомерия карбоновых кислотПо строению углеродного скелета:СН3-СН2-СН2-СН2-СН2-СООН –
- 7. Физические свойства карбоновых кислотНизшие кислоты (содержащие до
- 8. Муравьиная кислота – при обычных условиях
- 9. Химические свойства карбоновых кислотОбщие свойства, характерные для
- 10. 2. Взаимодействие с металлами, стоящими в электрохимическом
- 11. 4. Взаимодействие с гидроксидами металлов:2 СН3СООН +
- 12. 6. Взаимодействие со спиртами:с образованием сложных эфиров
- 13. 7. Реакция присоединения по кратной связи –
- 14. Способы получения карбоновых кислот1. Окислением первичных спиртов
- 15. Значение карбоновых кислот1. Муравьиная кислота – ядовита,
- 16. 2. Уксусная кислота – бесцветная жидкость с
- 17. Уксусная кислота – хороший растворитель многих органических
- 18. 3. Важнейшими представителями высших предельных одноосновных кислот
- 19. 4. Простейшим представителем двухосновных карбоновых кислот является
- 20. Выберите правильный ответ:1. Название кислоты с формулой:
- 21. Слайд 21
- 22. Слайд 22
- 23. Слайд 23
- 24. Слайд 24
Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько карбоксильных функциональных групп.Общая формула карбоновых кислот – RCOOHГруппа атомов СООН – карбоксильная группа
Слайд 2Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько
карбоксильных функциональных групп.
Общая формула карбоновых кислот – RCOOH
Группа атомов СООН – карбоксильная группа
Общая формула карбоновых кислот – RCOOH
Группа атомов СООН – карбоксильная группа
Слайд 3Классификация карбоновых кислот
1. В зависимости от числа карбоксильных групп карбоновые кислоты
делят:
1)одноосновные – уксусная кислота
СН3СООН
2) двухосновные – щавелевая кислота
СООН-СООН
3) многоосновные – лимонная кислота -
СООН-СН2-С(ОН)-СН2-СООН
׀
СООН
1)одноосновные – уксусная кислота
СН3СООН
2) двухосновные – щавелевая кислота
СООН-СООН
3) многоосновные – лимонная кислота -
СООН-СН2-С(ОН)-СН2-СООН
׀
СООН
Слайд 42. В зависимости от природы углеводородного радикала карбоновые кислоты делят:
1) предельные
– СН3-СН2- СООН – пропановая кислота
2) непредельные – СН2 =СН-СООН – акриловая кислота
3) ароматические – С6Н5-СООН – бензойная кислота
2) непредельные – СН2 =СН-СООН – акриловая кислота
3) ароматические – С6Н5-СООН – бензойная кислота
Слайд 5Номенклатура карбоновых кислот
Название карбоновой кислоты образуется от названия соответствующего алкана с
добавлением суффикса –ов, окончания –ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы.
НСООН – метановая кислота (муравьиная)
СН3СООН – этановая кислота (уксусная)
СН3-СН2-СООН – пропановая кислота (пропионовая)
НСООН – метановая кислота (муравьиная)
СН3СООН – этановая кислота (уксусная)
СН3-СН2-СООН – пропановая кислота (пропионовая)
Слайд 6Изомерия карбоновых кислот
По строению углеродного скелета:
СН3-СН2-СН2-СН2-СН2-СООН – гексановая кислота
её изомер: СН3-СН2-СН2-СН-СООН
׀
СН3
2-метилпентановая кислота
СН3
2-метилпентановая кислота
Слайд 7Физические свойства карбоновых кислот
Низшие кислоты (содержащие до 4 атомов углерода) –
жидкости с характерным резким запахом.
Кислоты, содержащие от 4 до 9 атомов углерода, - вязкие маслянистые жидкости с неприятным запахом; содержащие более 9 атомов углерода – твёрдые вещества, нерастворимые в воде.
Температуры кипения карбоновых кислот увеличиваются с ростом молекулярной массы.
Кислоты, содержащие от 4 до 9 атомов углерода, - вязкие маслянистые жидкости с неприятным запахом; содержащие более 9 атомов углерода – твёрдые вещества, нерастворимые в воде.
Температуры кипения карбоновых кислот увеличиваются с ростом молекулярной массы.
Слайд 8 Муравьиная кислота – при обычных условиях жидкость с температурой кипения
100,8 градусов. В тоже время бутан, имеющий большую массу, в тех же условиях газообразен (температура кипения -0,5 градусов), это несоответствие температур кипения объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны водородными связями.
Муравьиная и уксусная кислота в воде растворимы неограниченно
Муравьиная и уксусная кислота в воде растворимы неограниченно
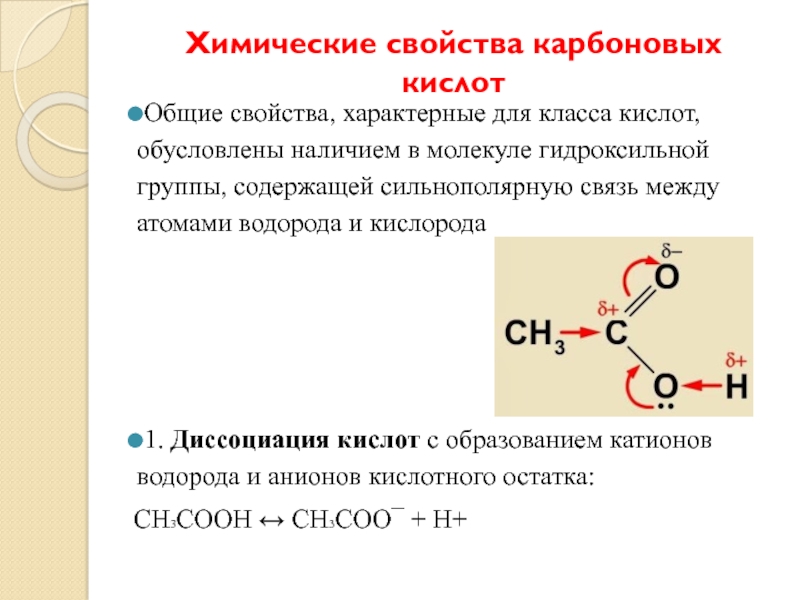
Слайд 9Химические свойства карбоновых кислот
Общие свойства, характерные для класса кислот, обусловлены наличием
в молекуле гидроксильной группы, содержащей сильнополярную связь между атомами водорода и кислорода
1. Диссоциация кислот с образованием катионов водорода и анионов кислотного остатка:
СН3СООН ↔ СН3СОО¯ + Н+
1. Диссоциация кислот с образованием катионов водорода и анионов кислотного остатка:
СН3СООН ↔ СН3СОО¯ + Н+
Слайд 102. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода:
2
СН3СООН + Са → (СН3СОО)2Са + Н2
3. Взаимодействие с основными оксидами с образованием соли и воды:
2 СН3СООН + СаО → (СН3СОО)2Са + Н2О
3. Взаимодействие с основными оксидами с образованием соли и воды:
2 СН3СООН + СаО → (СН3СОО)2Са + Н2О
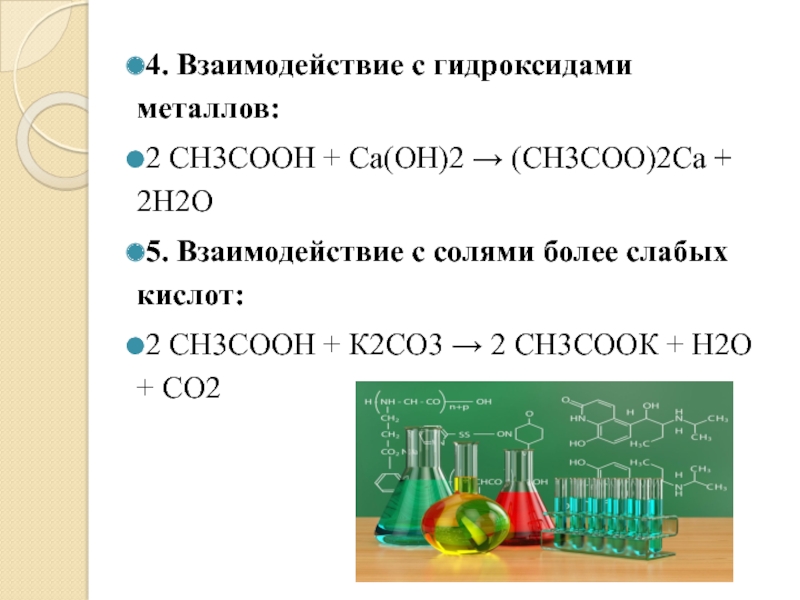
Слайд 114. Взаимодействие с гидроксидами металлов:
2 СН3СООН + Са(ОН)2 → (СН3СОО)2Са +
2Н2О
5. Взаимодействие с солями более слабых кислот:
2 СН3СООН + К2СО3 → 2 СН3СООК + Н2О + СО2
5. Взаимодействие с солями более слабых кислот:
2 СН3СООН + К2СО3 → 2 СН3СООК + Н2О + СО2
Слайд 126. Взаимодействие со спиртами:
с образованием сложных эфиров – реакция этерификации
СН3СООН +
С2Н5ОН → СН3СООС2Н5 + Н2О
Эта реакция катализируется ионами водорода, она обратима, равновесие смещается в сторону эфира в присутствии водоотнимающих веществ и удалении эфира из реакционной среды.
Эта реакция катализируется ионами водорода, она обратима, равновесие смещается в сторону эфира в присутствии водоотнимающих веществ и удалении эфира из реакционной среды.
Слайд 137. Реакция присоединения по кратной связи – в неё вступают непредельные
карбоновые кислоты, например реакция присоединения водорода – гидрирование
С17Н33СООН + Н2 →С17Н35СООН
8. Реакция замещения ( с галогенами)
СН3СООН + Cl2→ CH2Cl-COOH + HCl
хлоруксусная кислота
С17Н33СООН + Н2 →С17Н35СООН
8. Реакция замещения ( с галогенами)
СН3СООН + Cl2→ CH2Cl-COOH + HCl
хлоруксусная кислота
Слайд 14Способы получения карбоновых кислот
1. Окислением первичных спиртов и альдегидов:
СН3СОН + [О]
→ СН3СООН
2. Гидролизом сложных эфиров:
СН3СООС2Н5 + Н2О → СН3СООН + С2Н5ОН
2. Гидролизом сложных эфиров:
СН3СООС2Н5 + Н2О → СН3СООН + С2Н5ОН
Слайд 15Значение карбоновых кислот
1. Муравьиная кислота – ядовита, при попадании на кожу
вызывает ожоги. Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующими свойствами и поэтому находит своё применение в пищевой, кожевенной и фармацевтической промышленности, медицине, используется при крашении тканей и бумаги.
Слайд 162. Уксусная кислота – бесцветная жидкость с характерным запахом, водные растворы
уксусной кислоты поступают в продажу под названием уксуса (3-5% - ный раствор) и уксусной эссенции (70-80%-ный раствор) и широко используются в пищевой промышленности.
Слайд 17Уксусная кислота – хороший растворитель многих органических веществ и поэтому используется
при крашении, в кожевенном производстве, лакокрасочной промышленности. Уксусная кислота является сырьём для производства многих важных органических соединений: например на её основе получают вещества, используемые для борьбы с сорняками – гербициды.
Уксусная кислота является основным компонентом винного уксуса. Она продукт окисления этанола.
Уксусная кислота является основным компонентом винного уксуса. Она продукт окисления этанола.
Слайд 183. Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая и стеариновая
кислоты – это твёрдые вещества, плохо растворимые в воде.
Их соли – стеараты и пальмитаты – хорошо растворимы и обладают моющим действием, поэтому их ещё называют мылами. Эти вещества производят в больших масштабах.
Их соли – стеараты и пальмитаты – хорошо растворимы и обладают моющим действием, поэтому их ещё называют мылами. Эти вещества производят в больших масштабах.
Слайд 194. Простейшим представителем двухосновных карбоновых кислот является щавелевая кислота, соли которой
встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота – это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Слайд 20Выберите правильный ответ:
1. Название кислоты с формулой:
СН3—СН —
СН2—СООН
׀
СН3
а)3-метилбутановая;
б)2-метилбутановая;
в) 3-метилбутеновая;
г) 3,3-диметилпропановая
׀
СН3
а)3-метилбутановая;
б)2-метилбутановая;
в) 3-метилбутеновая;
г) 3,3-диметилпропановая











![Презентация по химии на тему Карбоновые кислоты Способы получения карбоновых кислот1. Окислением первичных спиртов и альдегидов:СН3СОН + [О] Способы получения карбоновых кислот1. Окислением первичных спиртов и альдегидов:СН3СОН + [О] → СН3СООН2. Гидролизом сложных эфиров:СН3СООС2Н5 +](/img/thumbs/58b4bf8fcb0ca3aa42d4341f16e4decc-800x.jpg)















