- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Карбоновые кислоты
Содержание
- 1. Презентация Карбоновые кислоты
- 2. ЦЕЛЬ:
- 3. ТИП УРОКА: изучение
- 4. План урока:Организационный момент2. Повторение материала предыдущего урока3. Изучение нового материала4. Закрепление
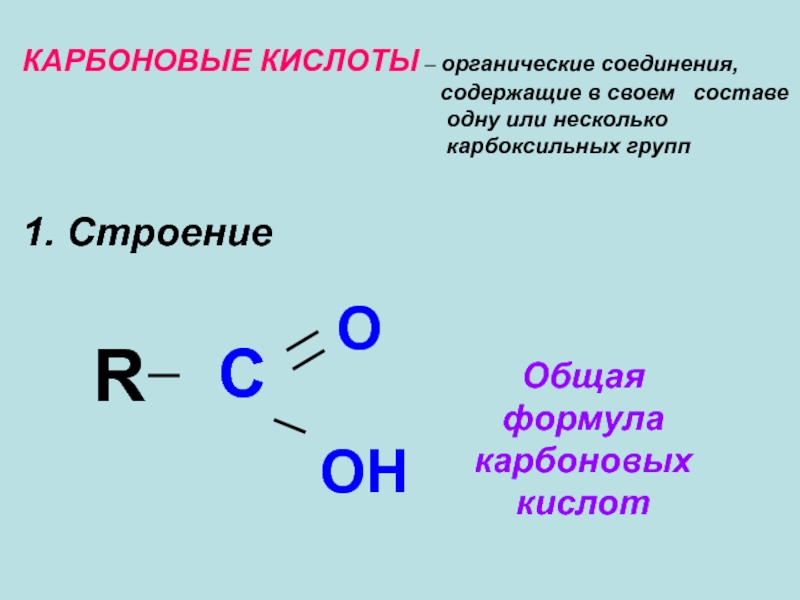
- 5. КАРБОНОВЫЕ КИСЛОТЫ – органические соединения,
- 6. СnH2nO2 Общая формула
- 7. КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТПО КОЛИЧЕСТВУ КАРБОКСИЛЬНЫХ ГРУППОДНООСНОВНЫЕМНОГООСНОВНЫЕ МЕТАНОВАЯ
- 8. КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТПО СТРОЕНИЮ УГЛЕРОДНОГО СКЕЛЕТАПРЕДЕЛЬНЫЕНЕПРЕДЕЛЬНЫЕАРОМАТИЧЕСКИЕ МЕТАНОВАЯ КИСЛОТАЭТАНОВАЯ КИСЛОТАБУТАНОВАЯ КИСЛОТАОЛЕИНОВАЯ КИСЛОТАЛИНОЛЕВАЯ КИСЛОТАЛИНОЛЕНОВАЯ КИСЛОТАБЕНЗОЙНАЯ КИСЛОТА
- 9. 2. НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТАлгоритм составления названий: 1.
- 10. МЕТАНОВАЯ КИСЛОТА(МУРАВЬИНАЯ КИСЛОТА)
- 11. Например: 2
- 12. СН3 – СН2 – СН2 – СН2
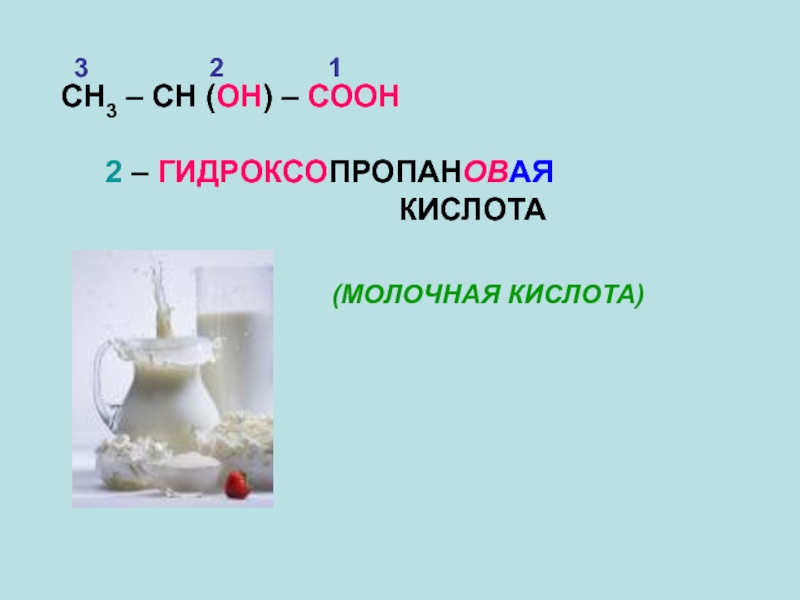
- 13. СН3 – СН (ОН) – СООН
- 14. ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМ ПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕСН3 –
- 15. ОТВЕТЫ2 – МЕТИЛПРОПАНОВАЯ КИСЛОТА2, 3 – ДИМЕТИЛПЕНТАНОВАЯ
- 16. ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТДля предельных карбоновых кислот: УГЛЕРОДНОГО
- 17. 3. Свойства3.1.ФизическиеС1 – С3 С4 – С9C10
- 18. 3.2. ХимическиеДИССОЦИАЦИЯ RCOOHRCOO + H2. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИCa + 2CH3COOH (CH3COO)2Ca + H2
- 19. 3.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ2 R – COOH
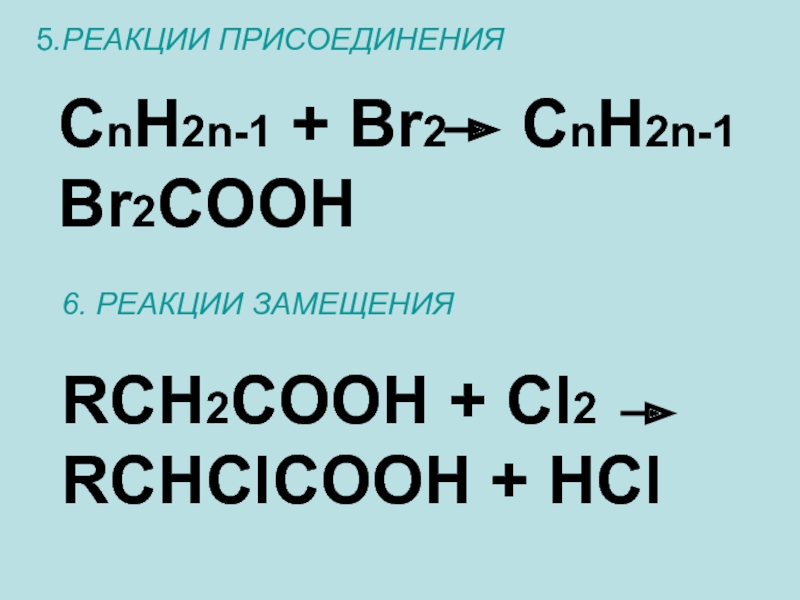
- 20. 5.РЕАКЦИИ ПРИСОЕДИНЕНИЯCnH2n-1 + Br2 CnH2n-1 Br2COOH 6. РЕАКЦИИ ЗАМЕЩЕНИЯRCH2COOH + Cl2 RCHClCOOH + HCl
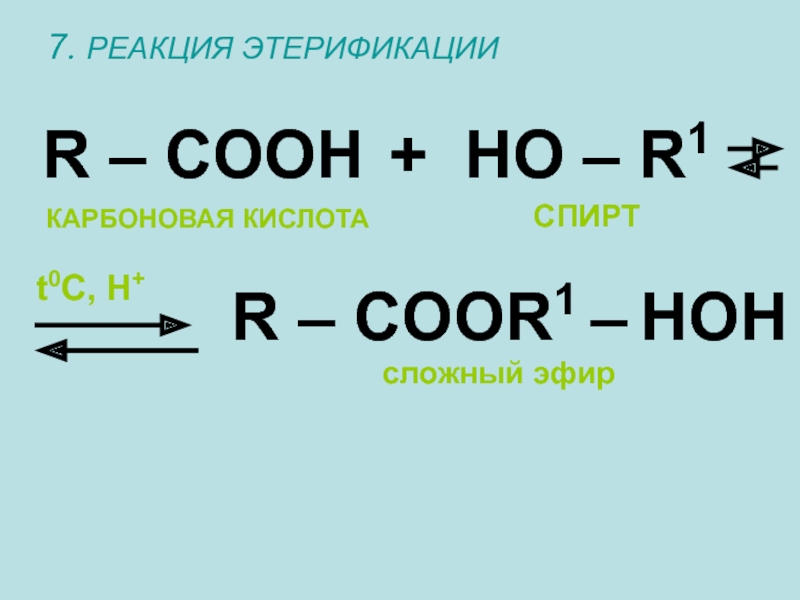
- 21. 7. РЕАКЦИЯ ЭТЕРИФИКАЦИИR – COOH + HO
- 22. 4. СПОСОБЫ ПОЛУЧЕНИЯОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ И
- 23. 2. ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСН3 – СООС2Н5 + НОНН+СН3 – СООН + С2Н5ОН
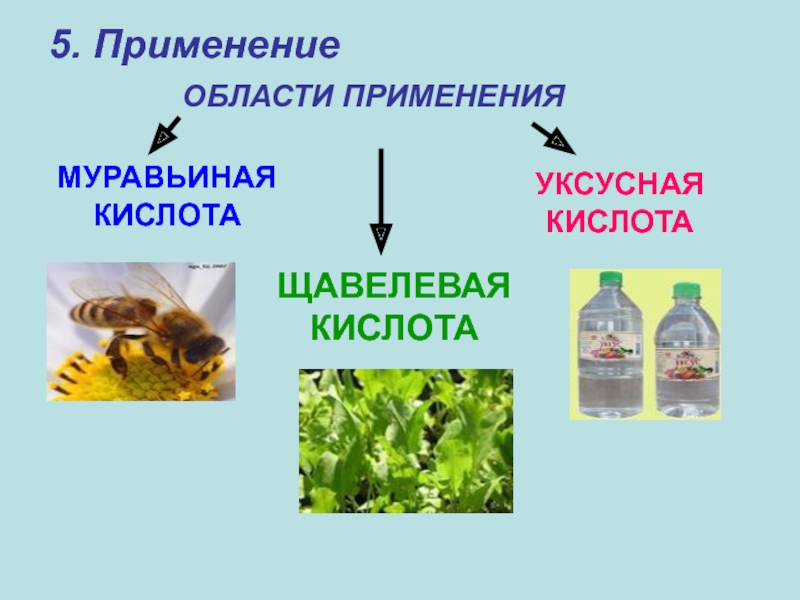
- 24. 5. Применение ОБЛАСТИ ПРИМЕНЕНИЯМУРАВЬИНАЯ КИСЛОТАУКСУСНАЯ КИСЛОТАЩАВЕЛЕВАЯКИСЛОТА
- 25. Муравьиная кислота:в текстильной промышленности (в качестве протравы
- 26. Уксусная кислота:в пищевой промышленности (для консервации);для получения
- 27. Щавелевая кислота:для отбеливания тканей;в производстве красителей;в кожевенной и деревообрабатывающей промышленности;для удаления ржавчины и накипи;в пищевой промышленности.
- 28. Слайд 28
- 29. ОТВЕТЫ:1.одноосновная, предельная2. одноосновная, непредельная3. одноосновная, предельная4. двухосновная, непредельная5. одноосновная, непредельная
- 30. Ссылки:http://engschool18.ru/newteacher/chemistry/page/4/ - рис. (слайд1)http://ru.encydia.com/en/Карбоксильная_кислота - рис. (слайд3)http://bankkrasoty.ua/preservatives/&page=2 – рис.(слайд10)http://900igr.net/fotografii/khimija/Karbonovye-kisloty-2/ - рис. (слайд12,13)http://www.itkgroup.ru/?meteg=karbonovie-kisloti-himiya-10-klass – рис.(слайд23)
- 31. Список литературы: Габриелян О.С. Химия: учеб.
- 32. Спасибо за внимание!
Слайд 1Войнич Елена Александровна, преподаватель химии, 1кв.кат. ГАОУ «Полярнозоринский энергетический колледж» Мурманская
Слайд 2 ЦЕЛЬ: дать характеристику карбоновым
Слайд 4План урока:
Организационный момент
2. Повторение материала предыдущего урока
3. Изучение нового
4. Закрепление
Слайд 5
КАРБОНОВЫЕ КИСЛОТЫ – органические соединения,
одну или несколько
карбоксильных групп
1. Строение
R
C
O
OH
Общая формула
карбоновых кислот
Слайд 6 СnH2nO2 Общая формула карбоновых кислот
14n +32
Формула для расчета
молекулярной массы
предельных карбоновых кислот
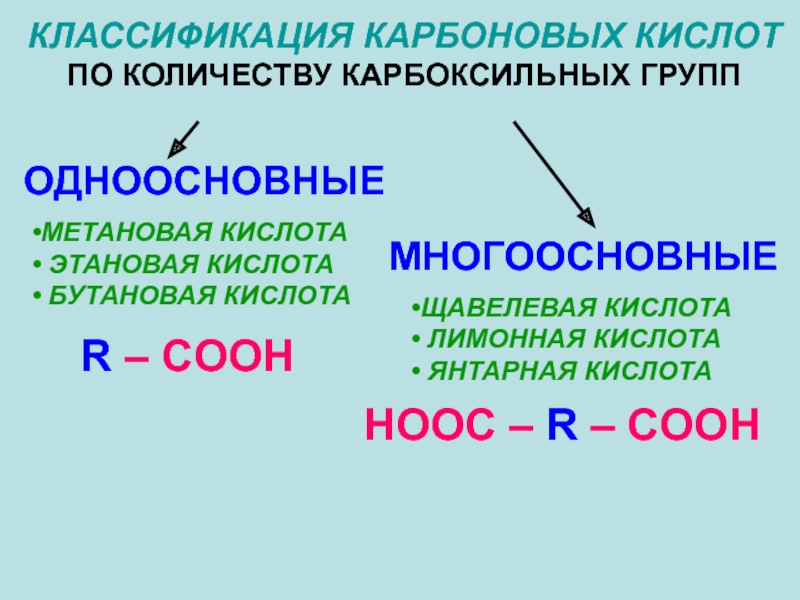
Слайд 7КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ
ПО КОЛИЧЕСТВУ КАРБОКСИЛЬНЫХ ГРУПП
ОДНООСНОВНЫЕ
МНОГООСНОВНЫЕ
МЕТАНОВАЯ КИСЛОТА
ЭТАНОВАЯ КИСЛОТА
БУТАНОВАЯ
ЩАВЕЛЕВАЯ КИСЛОТА
ЛИМОННАЯ КИСЛОТА
ЯНТАРНАЯ КИСЛОТА
R – COOH
HOOC – R – COOH
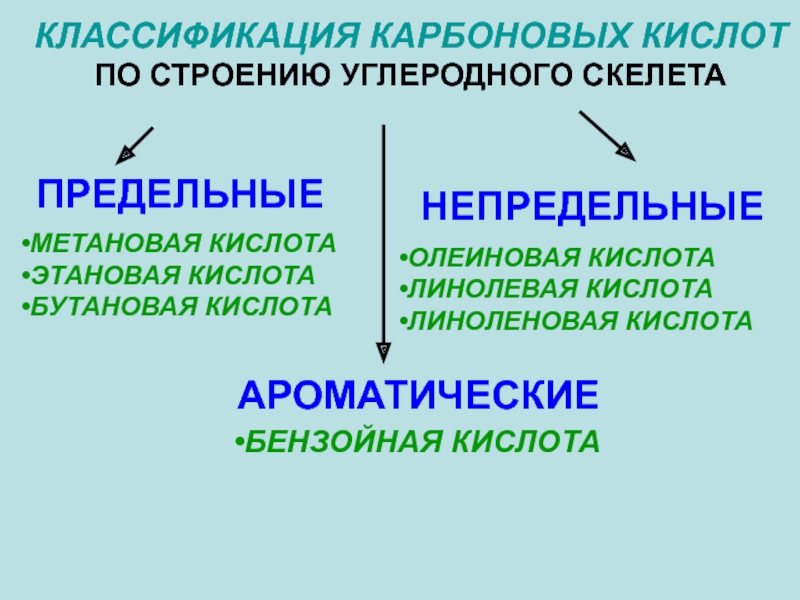
Слайд 8КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ
ПО СТРОЕНИЮ УГЛЕРОДНОГО СКЕЛЕТА
ПРЕДЕЛЬНЫЕ
НЕПРЕДЕЛЬНЫЕ
АРОМАТИЧЕСКИЕ
МЕТАНОВАЯ КИСЛОТА
ЭТАНОВАЯ КИСЛОТА
БУТАНОВАЯ КИСЛОТА
ОЛЕИНОВАЯ КИСЛОТА
ЛИНОЛЕВАЯ
ЛИНОЛЕНОВАЯ КИСЛОТА
БЕНЗОЙНАЯ КИСЛОТА
Слайд 92. НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ
Алгоритм составления названий:
1. Найдите главную (самую длинную)
2. Пронумеруйте углеродные атомы главной цепь начиная с углерода карбоксильной группы;
3. Назовите соединение по алгоритму углеводородов;
4. В конце названия допишите суффикс «ов» и окончание «ая» и слово «кислота»
АЛКАН + ОВ + АЯ КИСЛОТА
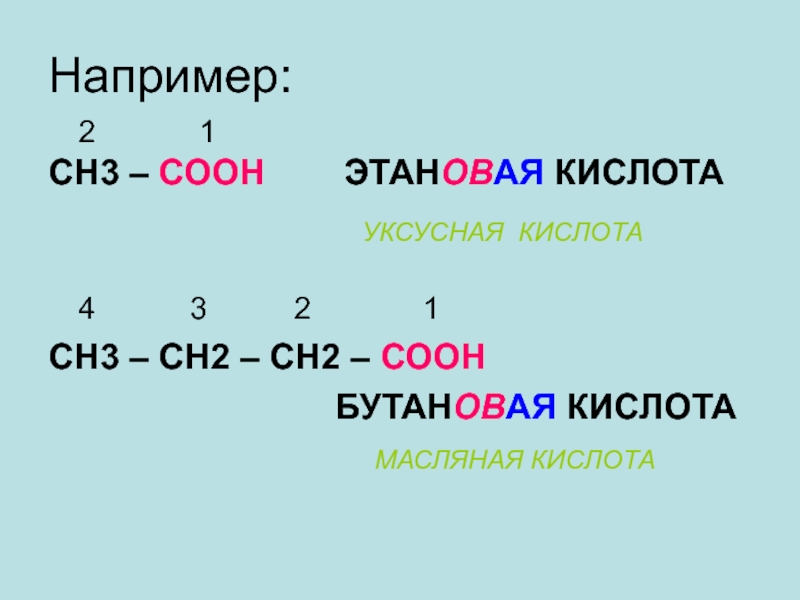
Слайд 11Например:
2 1
СН3 – СООН
4 3 2 1
СН3 – СН2 – СН2 – СООН
БУТАНОВАЯ КИСЛОТА
МАСЛЯНАЯ КИСЛОТА
УКСУСНАЯ КИСЛОТА
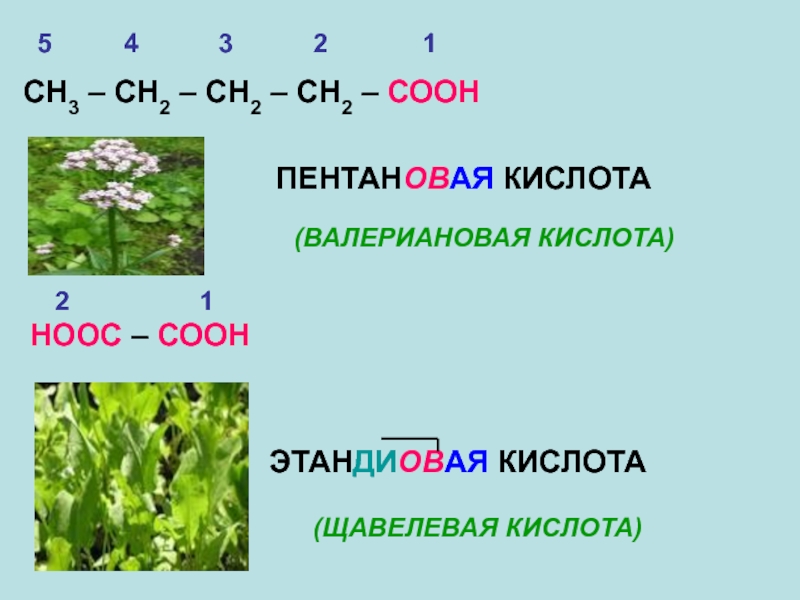
Слайд 12СН3 – СН2 – СН2 – СН2 – СООН
ПЕНТАНОВАЯ КИСЛОТА
(ВАЛЕРИАНОВАЯ
НООС – СООН
ЭТАНДИОВАЯ КИСЛОТА
(ЩАВЕЛЕВАЯ КИСЛОТА)
1
2
1
2
3
4
5
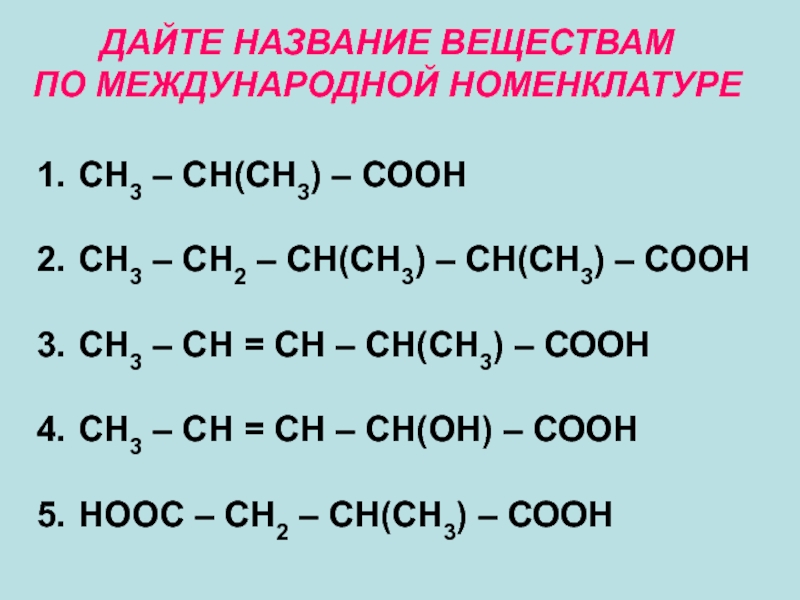
Слайд 14ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМ
ПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕ
СН3 – СН(СН3) – СООН
СН3
СН3 – СН = СН – СН(СН3) – СООН
СН3 – СН = СН – СН(ОН) – СООН
НООС – СН2 – СН(СН3) – СООН
Слайд 15ОТВЕТЫ
2 – МЕТИЛПРОПАНОВАЯ КИСЛОТА
2, 3 – ДИМЕТИЛПЕНТАНОВАЯ КИСЛОТА
2 – МЕТИЛПЕНТЕН –
2 – ГИДРОКСОПЕНТЕН – 3 – ОВАЯ КИСЛОТА
2 – МЕТИЛБУТАНДИОВАЯ КИСЛОТА
Слайд 16ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТ
Для предельных карбоновых кислот:
УГЛЕРОДНОГО СКЕЛЕТА
МЕЖКЛАССОВАЯ (СЛОЖНЫЕ ЭФИРЫ)
Для
УГЛЕРОДНОГО СКЕЛЕТА
ПОЛОЖЕНИЯ КРАТНОЙ СВЯЗИ
МЕЖКЛАССОВАЯ
Слайд 173. Свойства
3.1.Физические
С1 – С3
С4 – С9
C10 и >
Жидкости с характерным
Вязкие маслянистые жидкости с неприятным запахом, плохо растворимые
в воде
Твердые вещества,
не имеющие запаха, не растворимые в воде
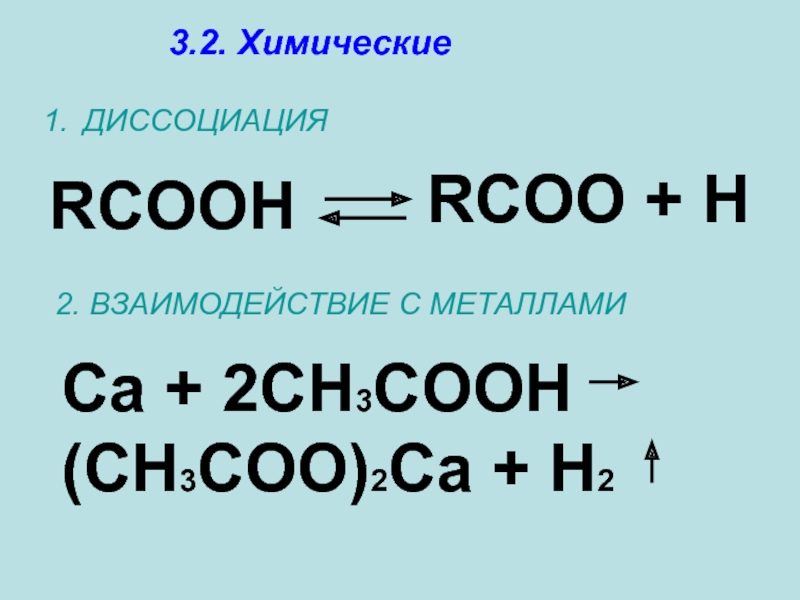
Слайд 183.2. Химические
ДИССОЦИАЦИЯ
RCOOH
RCOO + H
2. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
Ca + 2CH3COOH
(CH3COO)2Ca
Слайд 193.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
2 R – COOH + MgO =
4.ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИ
R – COOH + NaOH =
R – COONa + H2O
Слайд 205.РЕАКЦИИ ПРИСОЕДИНЕНИЯ
CnH2n-1 + Br2 CnH2n-1 Br2COOH
6. РЕАКЦИИ ЗАМЕЩЕНИЯ
RCH2COOH +
Слайд 217. РЕАКЦИЯ ЭТЕРИФИКАЦИИ
R – COOH
+ HO – R1
R – COOR1
t0C, H+
сложный эфир
КАРБОНОВАЯ КИСЛОТА
СПИРТ
Слайд 224. СПОСОБЫ ПОЛУЧЕНИЯ
ОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ
И АЛЬДЕГИДОВ
СН3 – СН2
[О]
- Н2О
СН3 – СОН
СН3 – СООН
[О]
- Н2О
ПЕРВИЧНЫЙ СПИРТ
АЛЬДЕГИД
КАРБОНОВАЯ КИСЛОТА
Слайд 25Муравьиная кислота:
в текстильной промышленности (в качестве протравы при крашении тканей);
в кожевенной
в пищевой (для консервирования фруктов);
в медицине;
в производстве некоторых полимеров
Слайд 26Уксусная кислота:
в пищевой промышленности (для консервации);
для получения полимеров, красителей, сложных эфиров,
Широко используются соли уксусной кислоты:
ацетаты железа, хрома, алюминия в качестве протравы при крашении ткани;
ацетат меди – для борьбы с вредителями с/х;
ацетат свинца – для изготовления свинцовых белил
Слайд 27Щавелевая кислота:
для отбеливания тканей;
в производстве красителей;
в кожевенной и деревообрабатывающей промышленности;
для удаления
в пищевой промышленности.
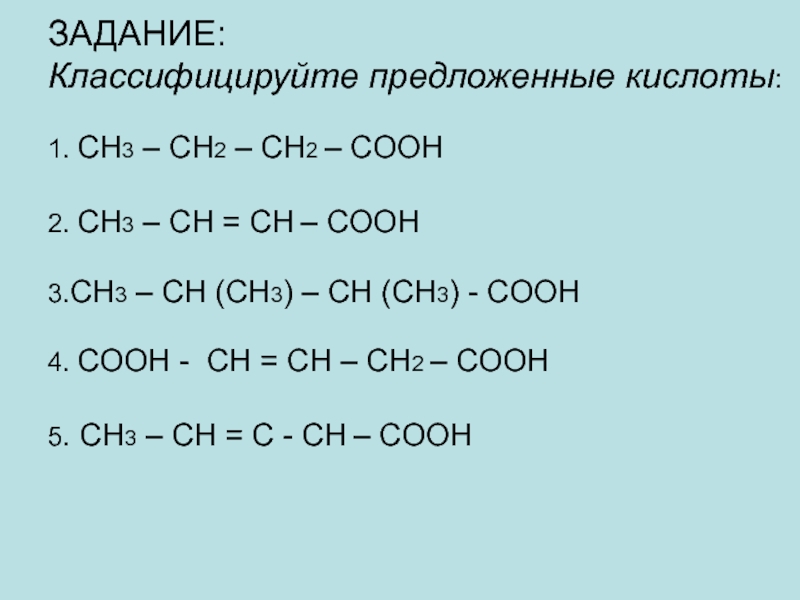
Слайд 28 ЗАДАНИЕ: Классифицируйте предложенные кислоты: 1. CH3 – CH2 – CH2 – COOH 2. CH3
Слайд 29ОТВЕТЫ:
1.одноосновная, предельная
2. одноосновная, непредельная
3. одноосновная, предельная
4. двухосновная, непредельная
5. одноосновная, непредельная
Слайд 30Ссылки:
http://engschool18.ru/newteacher/chemistry/page/4/ - рис. (слайд1)
http://ru.encydia.com/en/Карбоксильная_кислота - рис. (слайд3)
http://bankkrasoty.ua/preservatives/&page=2 – рис.(слайд10)
http://900igr.net/fotografii/khimija/Karbonovye-kisloty-2/ - рис.
http://www.itkgroup.ru/?meteg=karbonovie-kisloti-himiya-10-klass – рис.(слайд23)
Слайд 31Список литературы:
Габриелян О.С. Химия: учеб. для студ. Учреждений
Габриелян О.С., Остроумов И.Г. Химия: Пособие для поступающих в вузы. – М.: Дрофа, 2005.
Габриелян О.С., Остроумов И.Г., Введенская А.Г. Общая химия в тестах, задачах и упражнениях. – М. : Дрофа, 2003.
Пичугина Г.В. Химия и повседневная жизнь человека. – М.: Дрофа, 2004
Химия: Общая химия: Учебник для 11 класса общеобразовательных учреждений с углубленным изучением химии/ О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев. – М.: Просвещение, 2005.









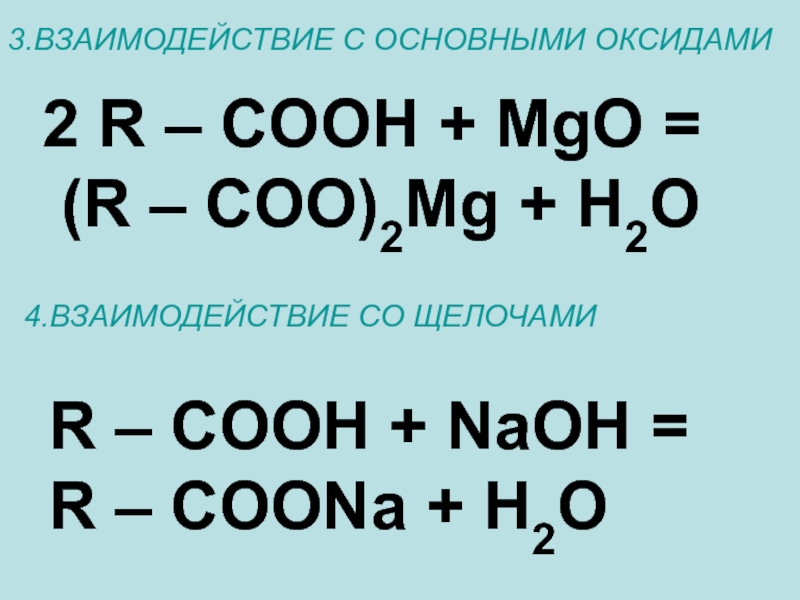
![Презентация Карбоновые кислоты 4. СПОСОБЫ ПОЛУЧЕНИЯОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ И АЛЬДЕГИДОВСН3 – СН2 – 4. СПОСОБЫ ПОЛУЧЕНИЯОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ И АЛЬДЕГИДОВСН3 – СН2 – ОН [О]- Н2ОСН3 – СОН СН3](/img/thumbs/0e0529f14697a5a8b92345abb586a7a7-800x.jpg)