- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Изменения в составе ядер химических элементов. Изотопы
Содержание
- 1. Презентация по химии на тему: Изменения в составе ядер химических элементов. Изотопы
- 2. Планетарная модель строения атома Резерфорд предположил, что
- 3. Ядро состоит из 2 частиц – протонов
- 4. Масса электрона ничтожна мала, поэтому ей можно
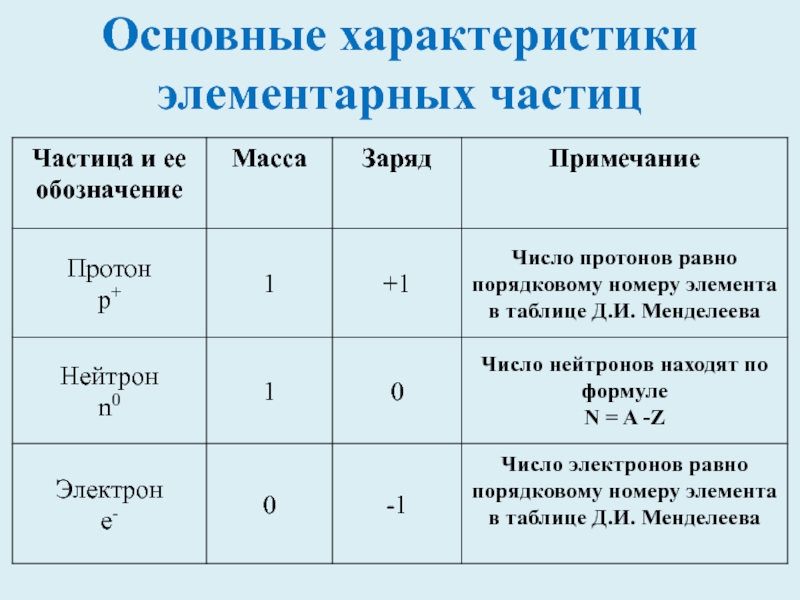
- 5. Основные характеристики элементарных частиц
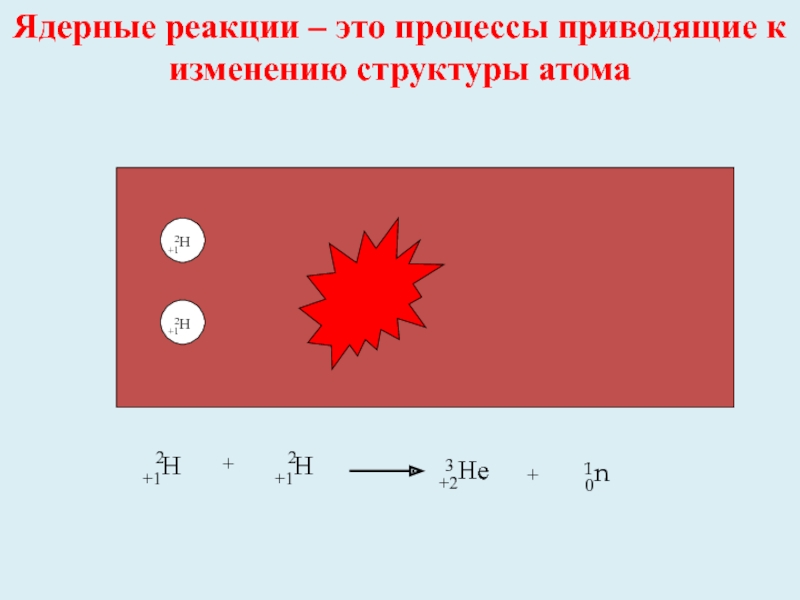
- 6. Ядерные реакции – это процессы приводящие к изменению структуры атома+1Н2+1Н2+1Не30n1+1Н2+1Н2++2Не30n1+
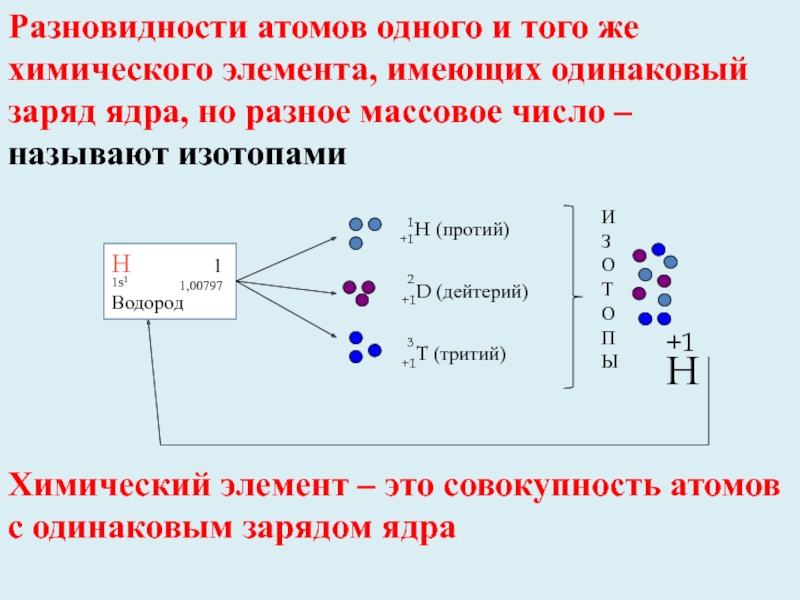
- 7. +1H (протий) +1D (дейтерий)+1T (тритий)Химический элемент –
- 8. Что произойдет с атомом элемента, если в
- 9. План характеристики химического элемента на основании его
- 10. ЗаданиеПриродный хлор состоит из 75% изотопа с
- 11. ЗаданиеОтносительная атомная масса углерода 12. Углерод существует
Слайд 2
Планетарная модель строения атома
Резерфорд предположил, что атом устроен подобно планетарной
Суть модели строения атома по Резерфорду заключается в следующем: в центре атома находится положительно заряженное ядро, в котором сосредоточена вся масса, вокруг ядра по круговым орбитам на больших расстояниях вращаются электроны (как планеты вокруг Солнца).
Заряд ядра совпадает с номером химического элемента в таблице Менделеева.
Слайд 3Ядро состоит из 2 частиц – протонов и нейтронов
Протоны имеют положительный
Нейтроны не несут заряда, они нейтральны и имеют массу, примерно равную массе протона
p ;p+
n ;n0
Слайд 4Масса электрона ничтожна мала, поэтому ей можно пренебречь
Обозначение электрона е
Сумма протонов
Слайд 6
Ядерные реакции – это процессы приводящие к изменению структуры атома
+1Н
2
+1Н
2
+1Не
3
0n
1
+1Н
2
+1Н
2
+
+2Не
3
0n
1
+
Слайд 7
+1H (протий)
+1D (дейтерий)
+1T (тритий)
Химический элемент – это совокупность атомов с
Н
1
1,00797
1s1
Водород
3
1
2
И
З
О
Т
О
П
Ы
+1H
Разновидности атомов одного и того же химического элемента, имеющих одинаковый заряд ядра, но разное массовое число – называют изотопами
Слайд 8Что произойдет с атомом элемента, если в его ядре изменить число
Например, в ядро атома фосфора добавить один протон.
+15P (15p+ + 16n0) + p+
Получится ядро другого химического элемента – серы
+16S (16p+ + 16n0) Аr = 32
В результате ядерных реакций получаются новые химические элементы.
+15P + p+= 16S
Слайд 9План характеристики химического элемента на основании его положения ПСХЭ Д.И. Менделеева
Номер
Порядковый номер химического элемента.
Заряд ядра атома химического элемента.
Количество протонов и нейтронов в ядре атома химического элемента.
Количество электронов в атоме химического элемента.
Слайд 10Задание
Природный хлор состоит из 75% изотопа с массовым числом 35 и
Рассчитайте атомную массу элемента.
Аr (Cl) = 35 x 0,75 + 37 x 0,25 = 26,25 + 9,25 = 35,5
Слайд 11Задание
Относительная атомная масса углерода 12. Углерод существует в природе в виде
Рассчитайте массовую долю этих изотопов.
x - доля первого изотопа.
(1-x) - доля второго изотопа.
Составим и решим уравнение:
11x + 14(1-x) = 12
x = 0,67; w(11C) = 0,67
(1-x) = 0,33; w(14C) = 0,33