- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химические уравнения
Содержание
- 1. Презентация по химии на тему Химические уравнения
- 2. Цель урокапродолжить формирование умения записывать уравненияопределять типы химических реакцийразвивать навыки проведения лабораторных работ
- 3. План урокаРазминка (поиграем – типы реакций)Проверка домашнего
- 4. Домашняя контрольная работаЗапишите уравнения реакций посхемам. Укажите
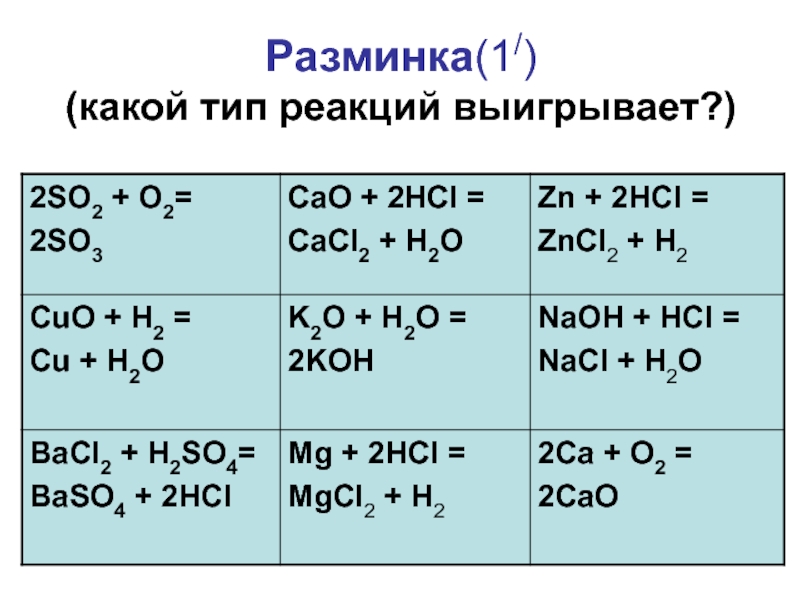
- 5. Разминка(1/) (какой тип реакций выигрывает?)
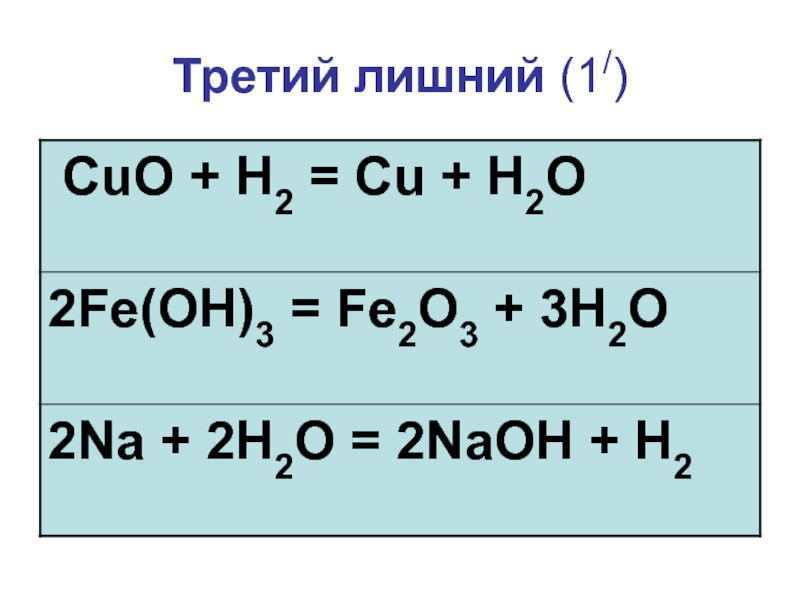
- 6. Третий лишний (1/)
- 7. Проверка домашнего заданияУпр.3 стр. 100А) H3PO4 +3NaOH=Na3PO4+3H2O
- 8. Проверка домашнего заданияУпр.4 а,б стр. 1011 моль
- 9. Накопительное тестирование
- 10. 1. Определить тип реакции (0,5/)Тип реакции1)
- 11. 2. Даны схемы реакций – написать уравнения
- 12. 3. Лабораторный опыт (работа в группах -
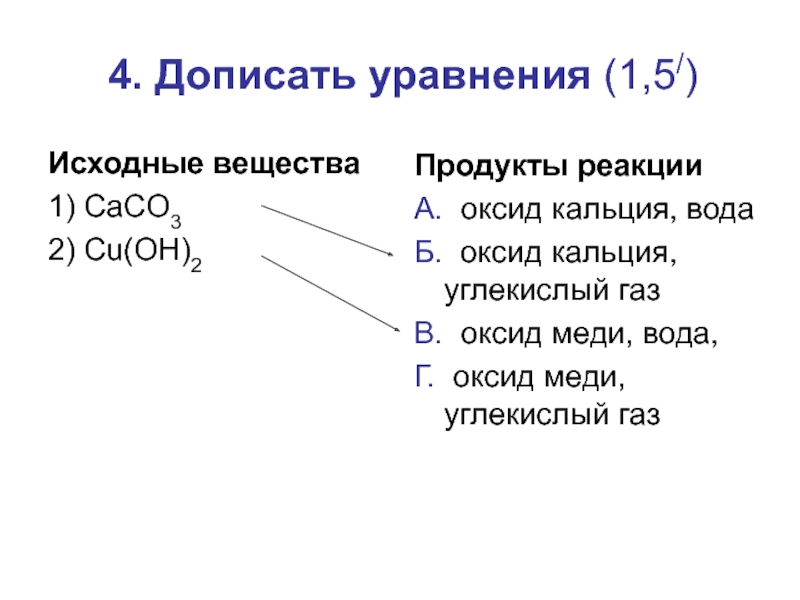
- 13. 4. Дописать уравнения (1,5/)Исходные вещества1) CaCO32) Cu(OH)2Продукты
- 14. 4. Дописать уравнения1Б. CaCO3 = CaO + CO22В. Cu(OH)2 = CuO + H2O
- 15. 5. Просмотреть фильм, написать уравнение реакции (1/)4P + 5O2 = 2P2O5
- 16. 6. Просмотреть фильм, написать уравнение реакции (1/)Cu + Cl2 = CuCl2
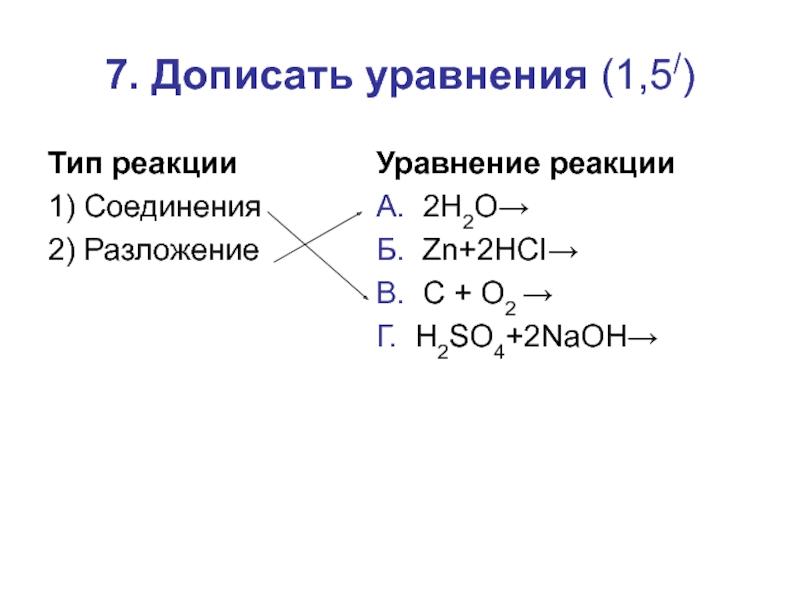
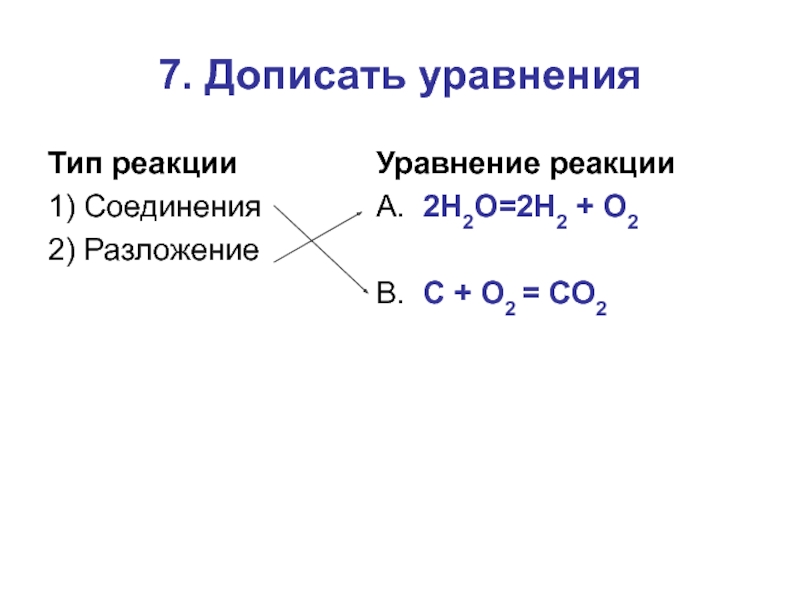
- 17. 7. Дописать уравнения (1,5/)Тип реакции1) Соединения2) РазложениеУравнение реакцииА. 2H2O→Б. Zn+2HCI→В. C + O2 →Г. H2SO4+2NaOH→
- 18. 7. Дописать уравненияТип реакции1) Соединения2) РазложениеУравнение реакцииА. 2H2O=2H2 + O2В. C + O2 = CO2
- 19. Итоги накопительного тестирования «5» - 7 баллов
- 20. Самостоятельная работа3 вариантСоединенияРазложенияЗамещенияОбмена4 вариантСоединенияРазложенияЗамещенияОбмена
- 21. Самостоятельная работа3 вариантСоединения 1,4Разложения -Замещения 3,8,9Обмена
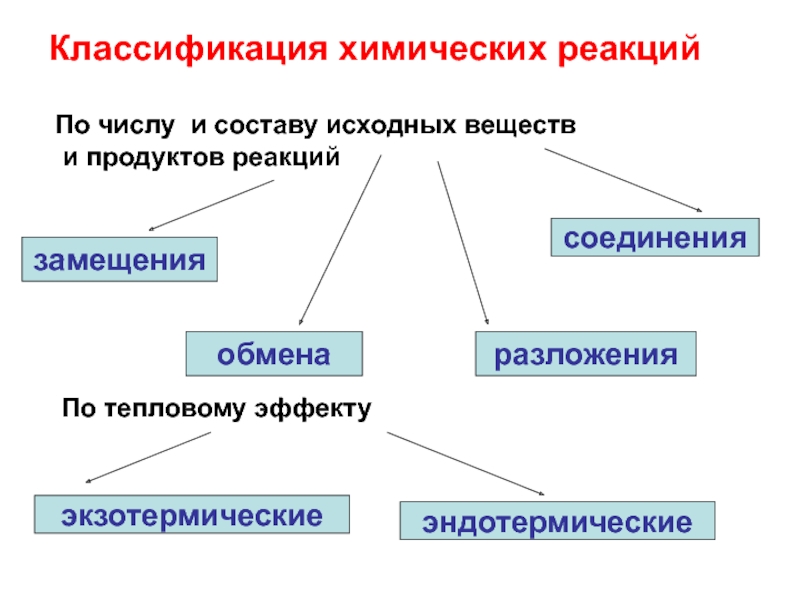
- 22. Классификация химических реакцийзамещенияобменаразложениясоединенияПо числу и составу исходных веществ и продуктов реакцийПо тепловому эффектуэкзотермическиеэндотермические
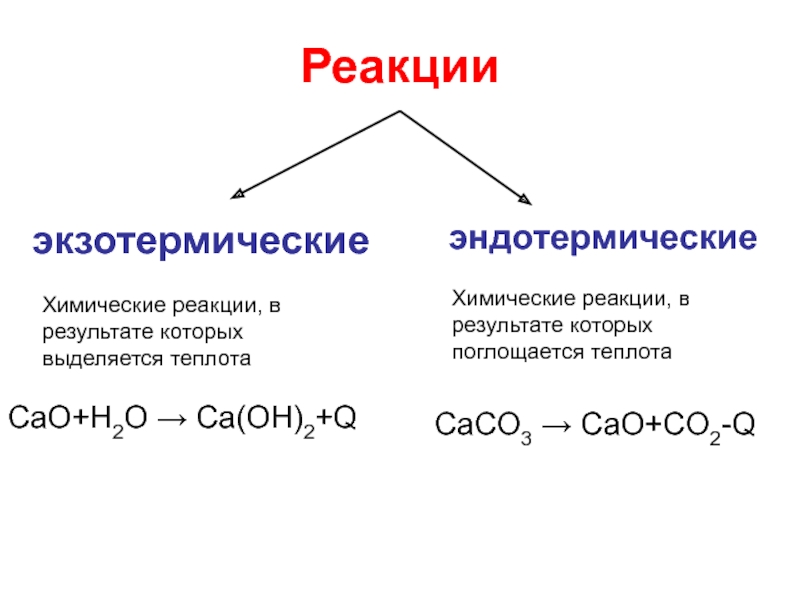
- 23. РеакцииэкзотермическиеэндотермическиеХимические реакции, в результате которых выделяется теплотаХимические
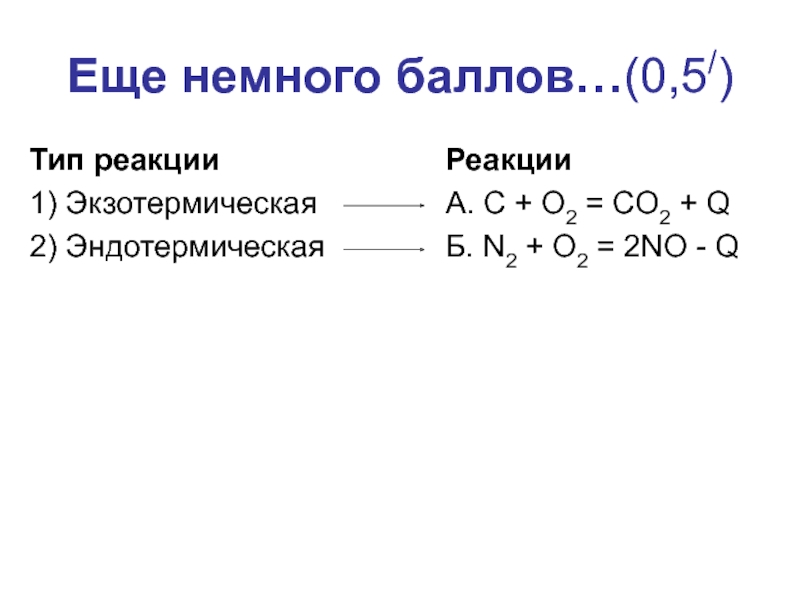
- 24. Еще немного баллов…(0,5/)Тип реакции1) Экзотермическая2) ЭндотермическаяРеакцииА. C
- 25. Еще немного баллов…(0,5/)Реакции1).2H2+O2=H2O+572кДж2).2HgO=2Hg+O2-180 кДжТип реакцииА. ЭндотермическаяБ. Экзотермическая
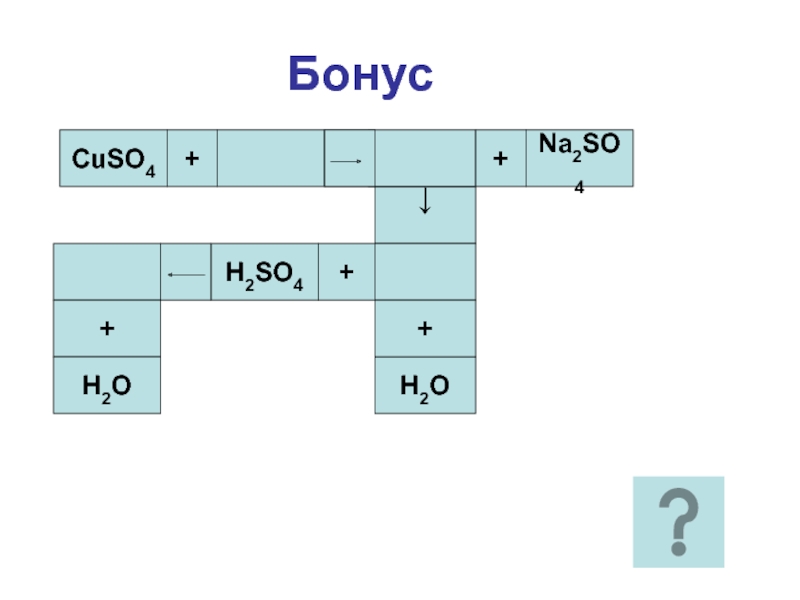
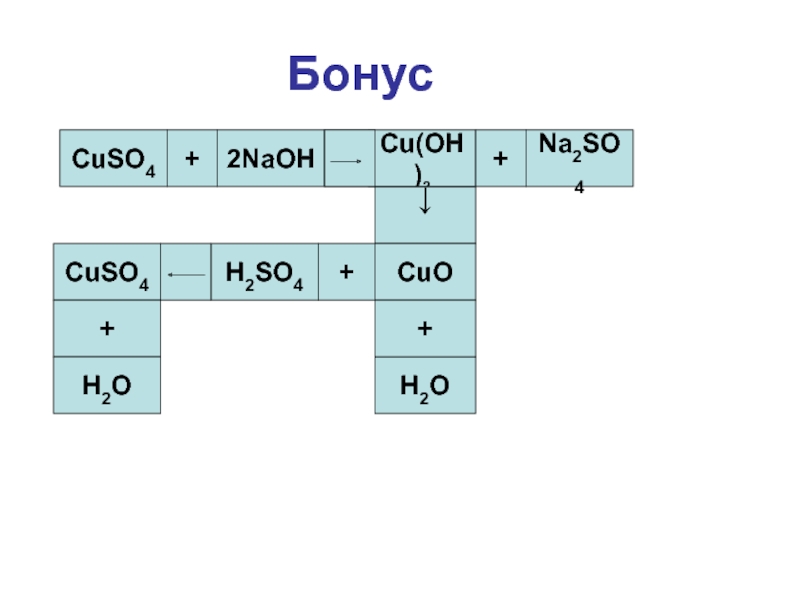
- 26. БонусCuSO4+=+Na2SO4↓H2O++H2SO4+H2O
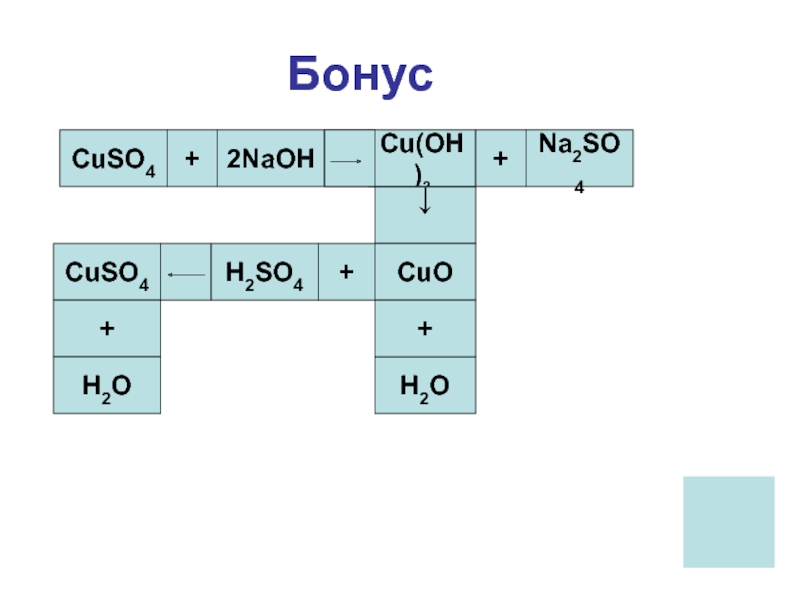
- 27. БонусCuSO4+2NaOH=Cu(OH)2+Na2SO4↓CuOH2O++H2SO4CuSO4+H2O
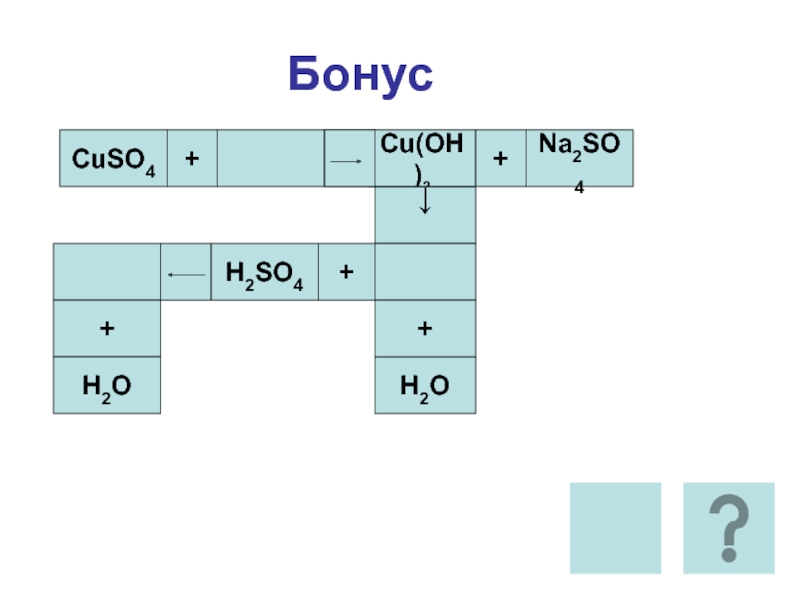
- 28. БонусCuSO4+=Cu(OH)2+Na2SO4↓H2O++H2SO4+H2O
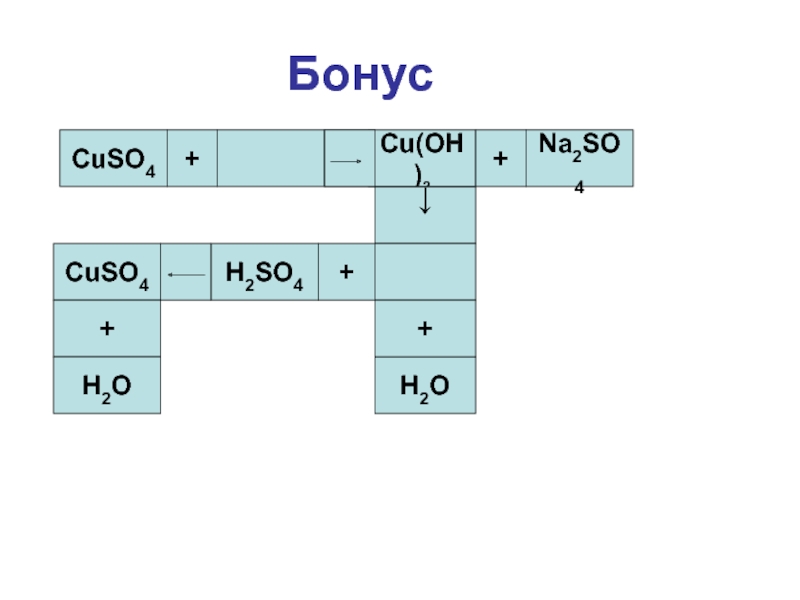
- 29. БонусCuSO4+=Cu(OH)2+Na2SO4↓H2O++H2SO4CuSO4+H2O
- 30. БонусCuSO4+2NaOH=Cu(OH)2+Na2SO4↓CuOH2O++H2SO4CuSO4+H2O
- 31. Слайд 31
Цель урокапродолжить формирование умения записывать уравненияопределять типы химических реакцийразвивать навыки проведения лабораторных работ
Слайд 2Цель урока
продолжить формирование умения записывать уравнения
определять типы химических реакций
развивать навыки проведения
лабораторных работ
Слайд 3План урока
Разминка (поиграем – типы реакций)
Проверка домашнего задания (взаимопроверка)
Отработка навыков написания
уравнений (накопительное тестирование)
Проведение лабораторного опыта
Задание на дом: домашняя контрольная работа (подготовка к ТУЗу)
Проведение лабораторного опыта
Задание на дом: домашняя контрольная работа (подготовка к ТУЗу)
Слайд 4Домашняя контрольная работа
Запишите уравнения реакций по
схемам. Укажите их тип:
а) гидроксид железа
(III) → оксид железа + вода
б) нитрат бария + сульфат железа (III) → … + сульфат бария
в) оксид азота (V) + вода → …
2. Вычислите объем водорода и кислорода (н.у.), которые образуются при разложении 90г воды.
б) нитрат бария + сульфат железа (III) → … + сульфат бария
в) оксид азота (V) + вода → …
2. Вычислите объем водорода и кислорода (н.у.), которые образуются при разложении 90г воды.
Слайд 7Проверка домашнего задания
Упр.3 стр. 100
А) H3PO4 +3NaOH=Na3PO4+3H2O –
обмена
Б) Na2O+H2O=2NaOH –
соединения
В) 3FeO
+ 2Al = Al2O3 + 3Fe –
замещения
Г) Cu(OH)2 = CuO + H2O –
разложения
замещения
Г) Cu(OH)2 = CuO + H2O –
разложения
Слайд 8Проверка домашнего задания
Упр.4 а,б стр. 101
1 моль
n/V
Fe2O3 + 3H2 = 2 Fe + 3H2O
1 моль 3 моль
А) n(H2) = 3 моль
Б) V(H2) = 67,2 л.
Fe2O3 + 3H2 = 2 Fe + 3H2O
1 моль 3 моль
А) n(H2) = 3 моль
Б) V(H2) = 67,2 л.
Слайд 10
1. Определить тип реакции (0,5/)
Тип реакции
1) Замещения
2) Обмена
Схема реакции
А. AB →
A + B
Б. A + BC →AC + B
В. A + B → AB
Г. AB + CD → AD + CB
Б. A + BC →AC + B
В. A + B → AB
Г. AB + CD → AD + CB
Слайд 112. Даны схемы реакций – написать уравнения реакций, указать тип (1/)
1
ряд
магний + соляная кислота→ водород + …
Mg + 2HCI =MgCI2 + H2
2 ряд
Цинк + Серная кислота → водород +…
Zn + H2SO4 = ZnSO4+H2
3 ряд
Серная кислота + алюминий → водород +…
3H2SO4 + 2AI = 3H2 +AI2(SO4) 3
магний + соляная кислота→ водород + …
Mg + 2HCI =MgCI2 + H2
2 ряд
Цинк + Серная кислота → водород +…
Zn + H2SO4 = ZnSO4+H2
3 ряд
Серная кислота + алюминий → водород +…
3H2SO4 + 2AI = 3H2 +AI2(SO4) 3
Слайд 123. Лабораторный опыт
(работа в группах - 3/)
Инструкция по технике безопасности
1 ряд:
NaOH+CuSO4 →
2NaOH+CuSO4 = Na2SO4 + Cu(OH) 2
2 ряд: AgNO3+HCl →
AgNO3+HCl = HNO3 + AgCI
3 ряд: H2SO4+BaCI2 →
H2SO4+BaCI2 = BaSO4 + 2HCI
2NaOH+CuSO4 = Na2SO4 + Cu(OH) 2
2 ряд: AgNO3+HCl →
AgNO3+HCl = HNO3 + AgCI
3 ряд: H2SO4+BaCI2 →
H2SO4+BaCI2 = BaSO4 + 2HCI
Слайд 134. Дописать уравнения (1,5/)
Исходные вещества
1) CaCO3
2) Cu(OH)2
Продукты реакции
А. оксид кальция, вода
Б.
оксид кальция, углекислый газ
В. оксид меди, вода,
Г. оксид меди, углекислый газ
В. оксид меди, вода,
Г. оксид меди, углекислый газ
Слайд 177. Дописать уравнения (1,5/)
Тип реакции
1) Соединения
2) Разложение
Уравнение реакции
А. 2H2O→
Б. Zn+2HCI→
В. C
+ O2 →
Г. H2SO4+2NaOH→
Г. H2SO4+2NaOH→
Слайд 187. Дописать уравнения
Тип реакции
1) Соединения
2) Разложение
Уравнение реакции
А. 2H2O=2H2 + O2
В. C
+ O2 = CO2
Слайд 20Самостоятельная работа
3 вариант
Соединения
Разложения
Замещения
Обмена
4 вариант
Соединения
Разложения
Замещения
Обмена
Слайд 21Самостоятельная работа
3 вариант
Соединения 1,4
Разложения -
Замещения 3,8,9
Обмена 2,5,6,7
4 вариант
Соединения
4,9
Разложения 5
Замещения 1,2,3
Обмена 6,7,8
Разложения 5
Замещения 1,2,3
Обмена 6,7,8
Критерии оценки
«Зачет» - 5 и более правильных выборов
Слайд 22Классификация химических реакций
замещения
обмена
разложения
соединения
По числу и составу исходных веществ
и продуктов реакций
По
тепловому эффекту
экзотермические
эндотермические
Слайд 23Реакции
экзотермические
эндотермические
Химические реакции, в результате которых выделяется теплота
Химические реакции, в результате которых
поглощается теплота
CaO+H2O → Ca(OH)2+Q
CaCO3 → CaO+CO2-Q
Слайд 24Еще немного баллов…(0,5/)
Тип реакции
1) Экзотермическая
2) Эндотермическая
Реакции
А. C + O2 = CO2
+ Q
Б. N2 + O2 = 2NO - Q
Б. N2 + O2 = 2NO - Q