- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химическая-связь
Содержание
- 1. Презентация по химии на тему Химическая-связь
- 2. Химическая связь – это силы взаимодействия, которые
- 3. Основные понятияМеталлы- это химические элементы, атомы которых
- 4. Типы химической связиКовалентнаяИонная Металли-ческаяВодородная
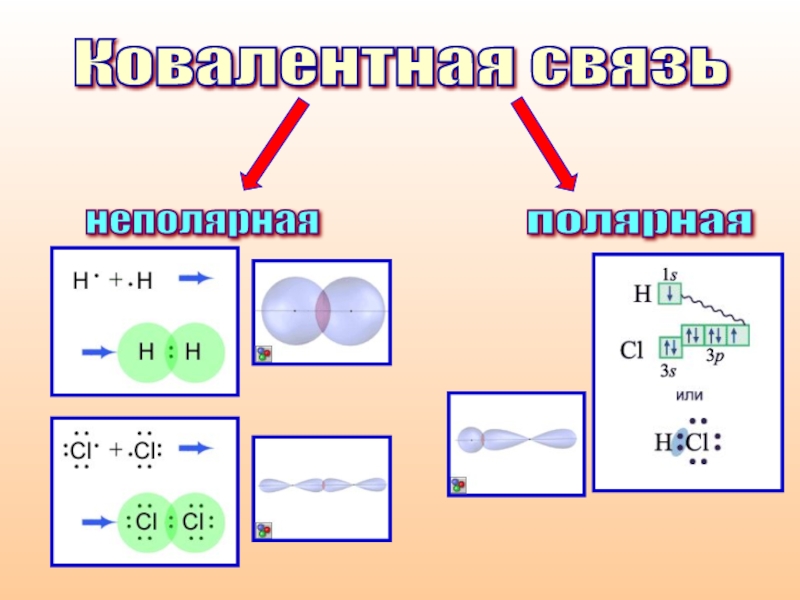
- 5. Ковалентная связь
- 6. Ковалентная связь неполярная полярная
- 7. Ковалентная связь возникает в результате образования общей
- 8. Рассмотрим образование молекулы водородаH H H H
- 9. Рассмотрим образование молекулы хлороводородаH + Cl =
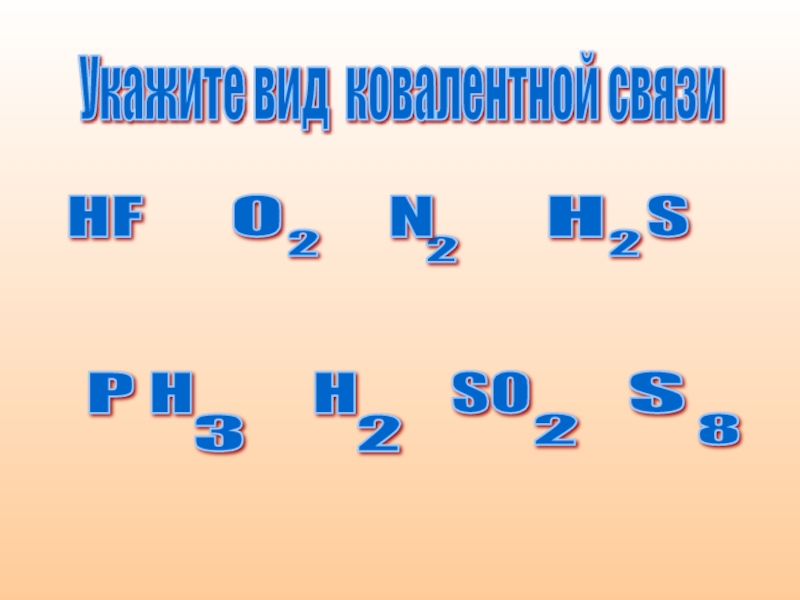
- 10. Укажите вид ковалентной связи HF O 2
- 11. полярная ковалентная связь HF H 2 S P H 3 SO 2
- 12. Неполярная ковалентная связь O 2 N 2 H 2 S 8
- 13. Решим небольшой тест.Укажите вещество с ковалентной полярной
- 14. 2. Укажите вещество с ковалентной неполярной связью:А) O3Б) HNO3В) SO3Г) COПравильный ответ - А
- 15. 3. Количество общих электронных пар называется:А) валентностьБ)
Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.Способность атома элемента образовывать различное число химических связей с другими атомами называется валентностью.
Слайд 2Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в
молекулы, ионы, кристаллы.
Способность атома элемента образовывать различное число химических связей с другими атомами называется валентностью.
Слайд 3Основные понятия
Металлы- это химические элементы, атомы которых легко отдают свои внешние
электроны, превращаясь в положительные ионы.
Неметаллы- это химические элементы, атомы которых принимают электроны на внешний уровень, превращаясь в отрицательные ионы
Ионы- заряженные частицы, в которые превращается атом после отдачи или принятия электронов.
Электроотрицательность- это способность атома химического элемента притягивать к себе электроны другого атома.
Химическая связь- это способ взаимодействия атомов, приводящий к образованию молекул.
Неметаллы- это химические элементы, атомы которых принимают электроны на внешний уровень, превращаясь в отрицательные ионы
Ионы- заряженные частицы, в которые превращается атом после отдачи или принятия электронов.
Электроотрицательность- это способность атома химического элемента притягивать к себе электроны другого атома.
Химическая связь- это способ взаимодействия атомов, приводящий к образованию молекул.
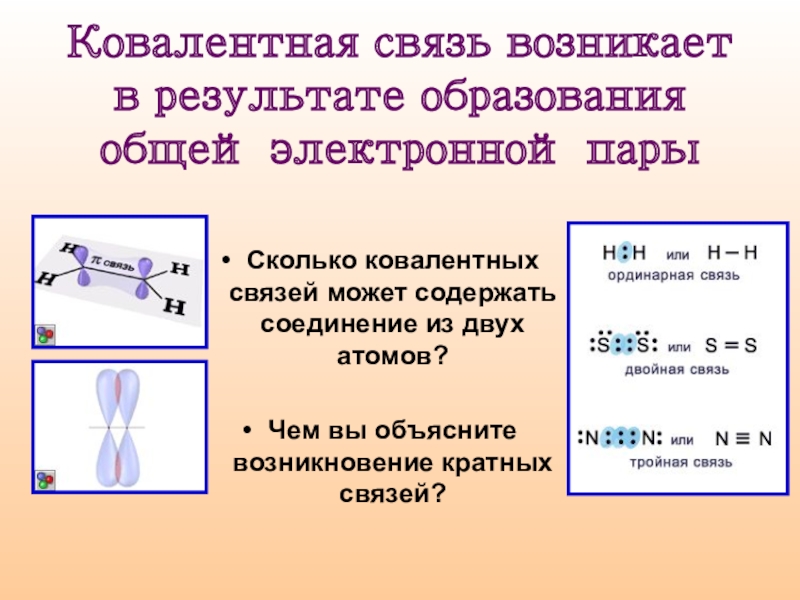
Слайд 7Ковалентная связь возникает в результате образования общей электронной пары
Сколько ковалентных связей
может содержать соединение из двух атомов?
Чем вы объясните возникновение кратных связей?
Чем вы объясните возникновение кратных связей?
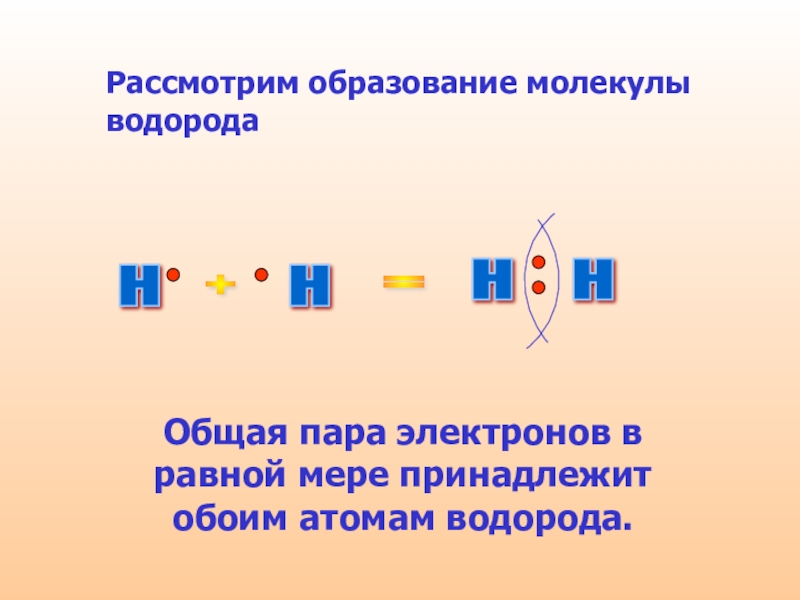
Слайд 8Рассмотрим образование молекулы водорода
H
H
H
H
+
=
Общая пара
электронов в равной мере принадлежит обоим атомам водорода.
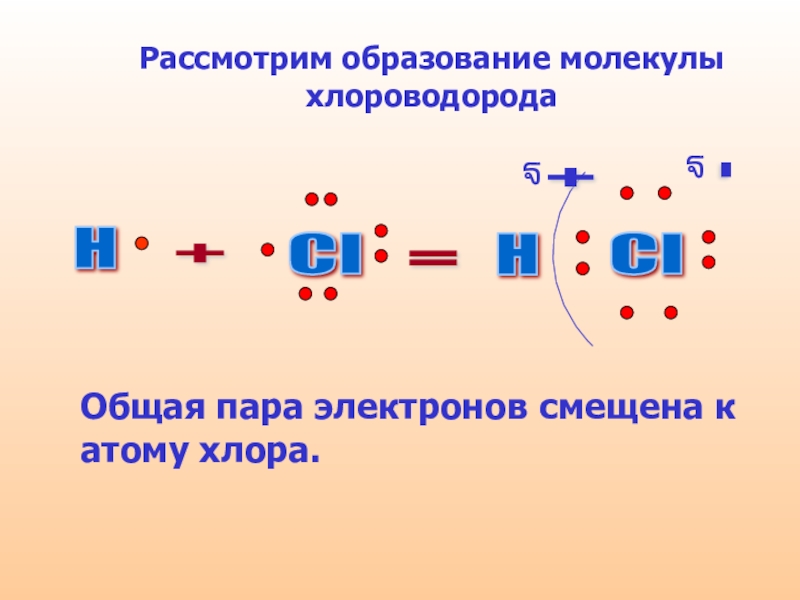
Слайд 9Рассмотрим образование молекулы хлороводорода
H
+
Cl
=
H
Cl
+
-
Общая пара электронов смещена к атому хлора.
Слайд 13Решим небольшой тест.
Укажите вещество с ковалентной полярной связью:
А) N2
Б) H2O
В)
P4
Г) O3
Г) O3
Правильный ответ - Б
Слайд 142. Укажите вещество с ковалентной неполярной связью:
А) O3
Б) HNO3
В) SO3
Г) CO
Правильный
ответ - А
Слайд 153. Количество общих электронных пар называется:
А) валентность
Б) химизм связи
В) идентичность связи
Г)
кратность связи
Правильный ответ - Г