- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Гидролиз солей 11 класс
Содержание
- 1. Презентация по химии на тему Гидролиз солей 11 класс
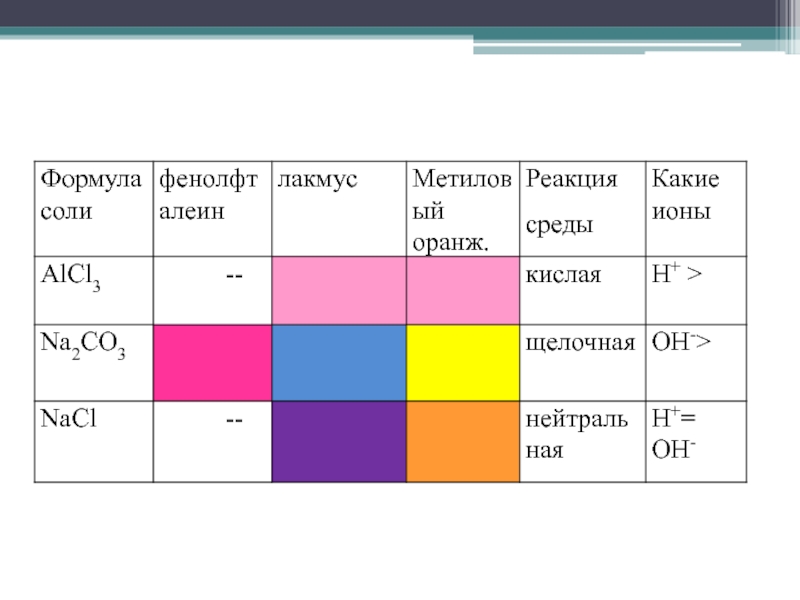
- 2. 1. Какие ионы окрашивают лакмус в красный
- 3. Вспомним, что вода – слабый электролит и
- 4. Слайд 4
- 5. Слово гидролиз произошло от двух греческих слов «Гидро»- вода и «лизос»- разложение.
- 6. Гидролиз солей- это обменная реакция соли с водой, приводящая к изменению среды раствора
- 7. Различают 4 типа гидролиза в зависимости от
- 8. Na2CO3 + HOH ↔ NaOH + NaHCO32Na+
- 9. AlCl3 + HOH ↔ HCl + AlOHCl2Al3+
- 10. NaCl + HOH ↔ NaOH + HClNa+
- 11. 2AlCl3 +3Na2S + 6H2O
- 12. 1) В чистой воде рН=7.2) Раствор соляной
- 13. Бланк химического диктанта.Фамилия,имя_____________________________________(+)ДА (-)НЕТ
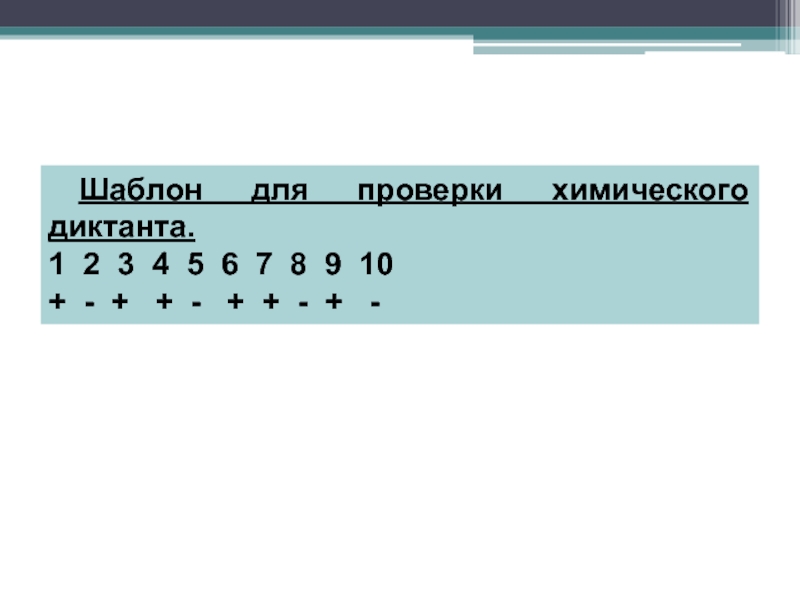
- 14. Шаблон для проверки химического диктанта.1 2 3
Слайд 21. Какие ионы окрашивают лакмус в красный цвет?
2. Какие ионы
З. Есть ли эти ионы в солях?
4. Является ли вода электролитом?
5. На какие ионы диссоциирует вода?
5. На какие ионы диссоциирует вода?
5. На какие ионы диссоциирует вода?
5. На какие ионы диссоциирует вода?
Слайд 3Вспомним, что вода – слабый электролит и в чистой воде происходит
НОН ↔ Н+ + ОН- и существует равенство концентрации:
[H+] = [OH –] = 10 – 7 моль/л.
pH = 7
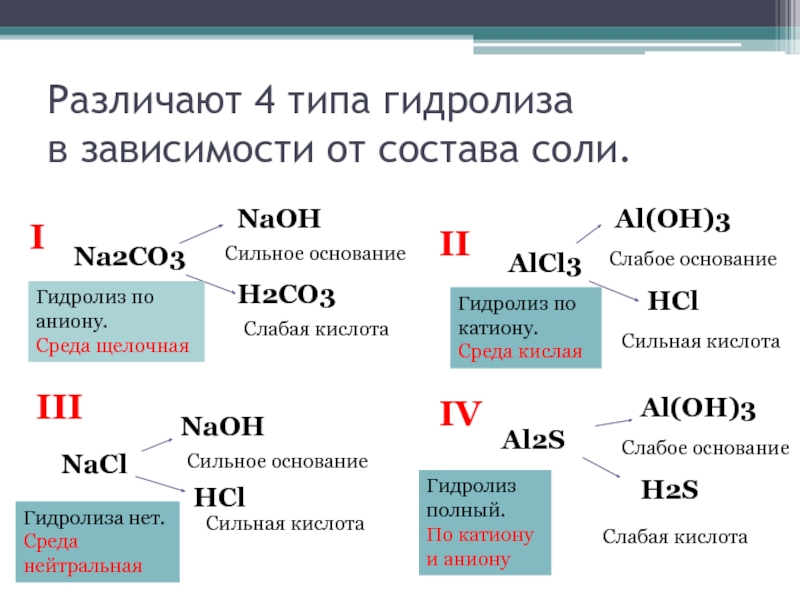
Слайд 7Различают 4 типа гидролиза
в зависимости от состава соли.
I
Na2CO3
NaOH
H2CO3
II
AlCl3
Al(OH)3
HCl
III
NaCl
NaOH
HCl
IV
Al2S
Al(OH)3
H2S
Сильное основание
Слабая кислота
Сильное основание
Сильная
Слабое основание
Сильная кислота
Слабое основание
Слабая кислота
Гидролиз по аниону.
Среда щелочная
Гидролиза нет.
Среда нейтральная
Гидролиз по катиону.
Среда кислая
Гидролиз полный.
По катиону и аниону
Слайд 8Na2CO3 + HOH ↔ NaOH + NaHCO3
2Na+ + CO32 – +
CO32 – + HOH ↔ OH – + HCO3 –
pH>7,
[H+] < [OH –].
Соль, образованная сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов.
Слайд 9AlCl3 + HOH ↔ HCl + AlOHCl2
Al3+ + 3Cl – +
Al3+ + HOH ↔ AlOH2+ + H+
pH<7,
[H+] > [OH –].
Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, так как в растворе избыток ионов водорода.
Слайд 10NaCl + HOH ↔ NaOH + HCl
Na+ + Cl – +
HOH ↔ OH – + H+
pH=7,
[H+] = [OH –].
Раствор соли, образованной сильным основанием и сильной кислотой имеет нейтральную среду, т.к. равенство концентраций ионов водорода и гидроксид-ионов не нарушено. Можно сказать, что такие соли гидролизу не подвергаются.
Слайд 112AlCl3 +3Na2S + 6H2O 6NaCl +2Al(OH)3 +
Соли, образованные слабым основанием и слабой летучей кислотой, подвергаются необратимому гидролизу, т.е. полностью разлагаются с образованием осадка и выделением газа.
Слайд 121) В чистой воде рН=7.
2) Раствор соляной кислоты – слабый электролит.
3
4)Соль AlCl3 образована слабым основанием и сильной кислотой.
5) Водный раствор соли NaCl имеет рН<7.
6)Водный раствор соли K2SO4 имеет рН=7.
7)Водный раствор соли Al2(SO4)3 имеет рН<7.
8)Соль KNO3 подвергается необратимому гидролизу с выпадением осадка.
9)Раствор соли Na2SiO3 при действии фенолфталеина окрасится в малиновый цвет.
10)Раствор соли K2CO3 при действии фенолфталеина остается бесцветным.
Химический диктант