- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Гидролиз (9 класс)
Содержание
- 1. Презентация по химии на тему Гидролиз (9 класс)
- 2. Цель урока: познакомиться с сущностью гидролиза солей
- 3. Давайте вспомним:1. Что такое электролиты и неэлектролиты?
- 4. Какая среда в водных растворах кислот? Какая
- 5. Какая среда в водных растворах солей?Задание: исследуйте
- 6. Соли, образованные сильным основанием и слабой кислотойкарбонат
- 7. Соли, образованные слабым основанием и сильной кислотой
- 8. Соли, образованные сильным основанием и сильной кислотой
- 9. Вывод: гидролизу подвергаются соли1. Соли, образованные сильным
- 10. Зада. Кислая среда будет в растворе:Задание 2.
- 11. ЗНАЧЕНИЕ ГИДРОЛИЗАРоль гидролиза в природе: - преобразование
- 12. СПАСИБО ЗА ВНИМАНИЕДомашнее задание:Параграф 6, упражнение 9,10
Слайд 2
Цель урока: познакомиться с сущностью гидролиза солей и научиться составлять уравнения
Слайд 3
Давайте вспомним:
1. Что такое электролиты и неэлектролиты? Какие электролиты называют сильными,
а какие слабыми?
2. Что такое кислота, щелочь и соль в свете теории электролитической диссоциации?
3. Как экспериментально определить характер среды?
4. Какая среда в водных растворах кислот? Какая среда в водных растворах щелочей?
Какая среда в воде?
Слайд 4Какая среда в водных растворах кислот? Какая среда в водных растворах
Какая среда в воде?
Раствор НСl
Раствор NaOH
Вода
Окраска лакмуса
Слайд 5
Какая среда в водных растворах солей?
Задание: исследуйте с помощью универсальной индикаторной
Слайд 6
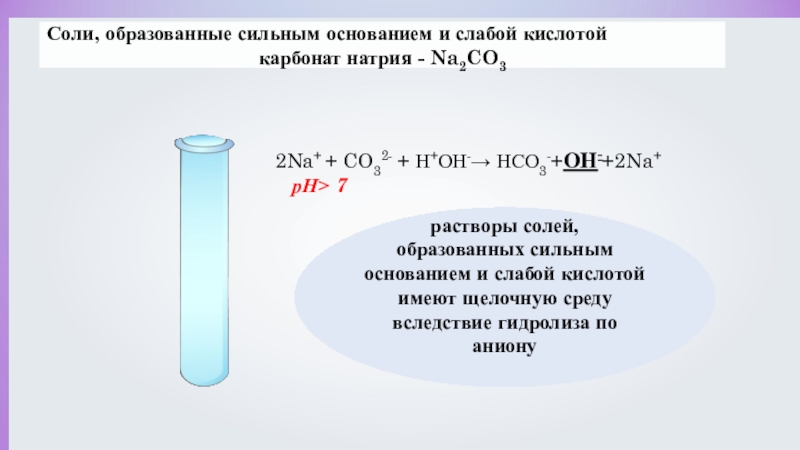
Соли, образованные сильным основанием и слабой кислотой
карбонат натрия - Na2CO3
растворы
2Na+ + CO32- + Н+ОН-→ НСО3-+ОН-+2Na+
рН˃ 7
Слайд 7
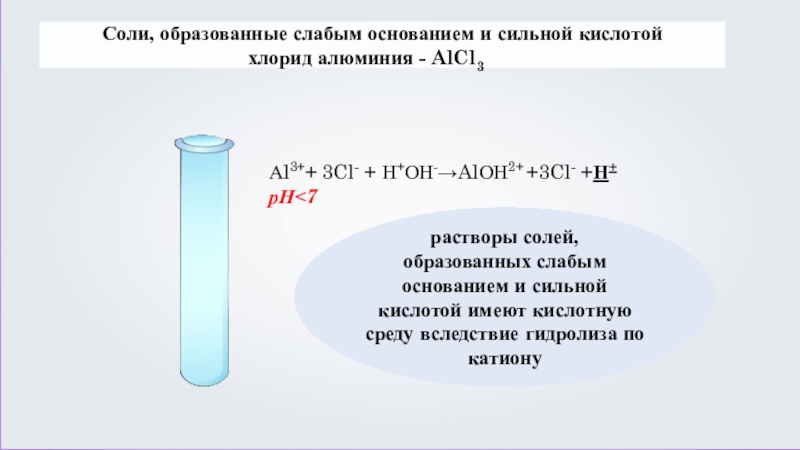
Соли, образованные слабым основанием и сильной кислотой
растворы солей, образованных слабым основанием и сильной кислотой имеют кислотную среду вследствие гидролиза по катиону
Аl3++ 3Cl- + Н+ОН-→AlОН2+ +3Cl- +Н+
рН˂7
Слайд 8
Соли, образованные сильным основанием и сильной кислотой хлорид натрия - NaCl
растворы
Na+- катион сильного основания,
Cl- - анион сильной кислоты.
рН=7
Слайд 9
Вывод: гидролизу подвергаются соли
1. Соли, образованные сильным основанием и слабой кислотой;
2. Соли, образованные слабым основанием и сильной кислотой растворы солей, образованных слабым основанием и сильной кислотой имеют кислотную среду вследствие гидролиза по катиону;
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются, поэтому их растворы нейтральны
Слайд 10
Зада. Кислая среда будет в растворе:
Задание 2. Кислая среда будет в
А) карбоната натрия Б) сульфата алюминия В) фосфата натрия Г) нитрата бария
Задание 3. Определите среду растворов солей, формулы которых:
BaCl2,KF, Na3PO4, Ca(NO3)2, ZnSO4, NaBr, CuCl2
Задание 1. Нейтральную среду имеет водный раствор:
А) NaNО3 Б) К2SO3 BВ) FeSO 4 Г) Zn(NO3)2
Задание 4. Выразите сущность реакций гидролиза солей, формулы которых:
Аl(NO3)3, K2SO3, MgSO4, FeBr3
Слайд 11
ЗНАЧЕНИЕ ГИДРОЛИЗА
Роль гидролиза в природе:
- преобразование земной коры, разрушение горных
- обеспечение слабощелочной среды морской воды
Роль гидролиза в народном хозяйстве:
- Разрушение производственного оборудования
- Выработка из непищевого сырья ценных продуктов
(бумага, мыло, спирт, глюкоза, белковые дрожжи)
- Очистка промышленных стоков и питьевой воды
- Подготовка тканей к окрашиванию
- Известкование почв
Роль гидролиза в повседневной жизни человека:
- Стирка
- Мытьё посуды
- Умывание с мылом
- Процессы пищеварения
Слайд 12СПАСИБО ЗА ВНИМАНИЕ
Домашнее задание:
Параграф 6, упражнение 9,10 стр. 22,
сообщение на