- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Гидролиз солей
Содержание
- 1. Презентация по химии на тему Гидролиз солей
- 2. Гидролиз – это реакция
- 3. Гидролиз произошло от греческих слов:
- 4. Сильные электролиты Сильные электролиты – это
- 5. + H
- 6. Если +
- 7. . Всякую соль можно рассматривать ,
- 8. Случаи гидролиза: 1. Na2CO3 – соль,
- 9. Гидролиз данной соли заключается в
- 10. +
- 11. 2. Pb(NO3)2 – соль образована слабым основанием
- 12. Гидролиз данной соли заключается в
- 13. 2+
- 14. 3. NaCL – соль образована сильным основанием
- 15. 4. AL2S3 – соль образована слабым основанием
- 16. Значение гидролиза При гидролизе древесины, подсолнечной лузги,
- 17. Значение гидролиза Гидролиз некоторых солей используют
- 18. Домашнее задание Записи выучить.Расписать гидролиз солей:а) CuSO4б) K3PO4в) Na2Sг) AL2(SO4)3
- 19. Проверка домашнего заданияа)
- 20. б)
- 21. в)
- 22. г)
- 23. Расписать гидролиз солей а) Li2CO3
- 24. Слайд 24
- 25. Слайд 25
- 26. Слайд 26
Гидролиз – это реакция обмена между солями и водой, в результате которой ионы слабого основания или слабой кислоты, входящие в состав соли, соединяются с составными частями молекул воды – с ионами
Слайд 2
Гидролиз – это реакция обмена между солями и
водой, в результате которой ионы слабого основания или слабой кислоты, входящие в состав соли, соединяются с составными частями молекул воды – с ионами
+ -
H или OH .
+ -
H или OH .
Слайд 4Сильные электролиты
Сильные электролиты – это химические соединения, которые при
растворении в воде полностью распадаются на ионы.
Кислоты: HCL, HBr, HI, HNO3,H2SO4.
Основания: LiOH, NaOH, KOH, RbOH,
CsOH, Ca(OH)2, Ba(OH)2,
Sr(OH)2.
Кислоты: HCL, HBr, HI, HNO3,H2SO4.
Основания: LiOH, NaOH, KOH, RbOH,
CsOH, Ca(OH)2, Ba(OH)2,
Sr(OH)2.
Слайд 7.
Всякую соль можно рассматривать , как продукт взаимодействия основания
и кислоты:
2NaOH + H2SO4 => Na2SO4 + 2H2O
2NaOH + H2SO4 => Na2SO4 + 2H2O
Слайд 8Случаи гидролиза:
1. Na2CO3 – соль, образована сильным основанием и
слабой кислотой.
Na2CO3
NaOH H2CO3
сильное основание слабая кислота
Na2CO3
NaOH H2CO3
сильное основание слабая кислота
Слайд 9
Гидролиз данной соли заключается в присоединении ионов кислотного остатка
к иону водорода и в освобождении гидоксид – ионов.
Раствор данной соли имеет щелочной характер.
Раствор данной соли имеет щелочной характер.
Слайд 10
+ 2- +
- - + -
2Na +CO3 +HOH < => HCO3 +2Na + OH
полное ионное уравнение гидролиза
2- + - - -
CO3 + HOH <=> HCO3 + OH
сокращенное ионное уравнение гидролиза
Na2CO3 + H2O <=> NaOH + NaHCO3
гидрокарбонат натрия
2Na +CO3 +HOH < => HCO3 +2Na + OH
полное ионное уравнение гидролиза
2- + - - -
CO3 + HOH <=> HCO3 + OH
сокращенное ионное уравнение гидролиза
Na2CO3 + H2O <=> NaOH + NaHCO3
гидрокарбонат натрия
Слайд 11
2. Pb(NO3)2 – соль образована слабым основанием и сильной кислотой.
Pb(NO3)2
Pb(OH)2 HNO3
слабое основание сильная кислота
Pb(OH)2 HNO3
слабое основание сильная кислота
Слайд 12
Гидролиз данной соли заключается в присоединении иона металла к
гидроксид-иону и в освобождении иона водорода.
Раствор данной соли имеет кислую среду.
Раствор данной соли имеет кислую среду.
Слайд 13
2+ -
+ - + + -
Pb + 2NO3 + HOH <=> H + PbOH + 2NO3
полное ионное уравнение гидролиза
2+ + - + +
Pb + HOH <=> PbOH + H
сокращенное ионное уравнение гидролиза
Pb(NO3)2 + H2O <=> HNO3 + PbOHNO3
нитрат гидроксид свинца
Pb + 2NO3 + HOH <=> H + PbOH + 2NO3
полное ионное уравнение гидролиза
2+ + - + +
Pb + HOH <=> PbOH + H
сокращенное ионное уравнение гидролиза
Pb(NO3)2 + H2O <=> HNO3 + PbOHNO3
нитрат гидроксид свинца
Слайд 14
3. NaCL – соль образована сильным основанием и сильной кислотой.
NaCL
NaOH HCL
Данная соль гидролизу не подвергается. Среда раствора нейтральная.
+ - + -
Na + CL + HOH <=>
NaOH HCL
Данная соль гидролизу не подвергается. Среда раствора нейтральная.
+ - + -
Na + CL + HOH <=>
Слайд 15
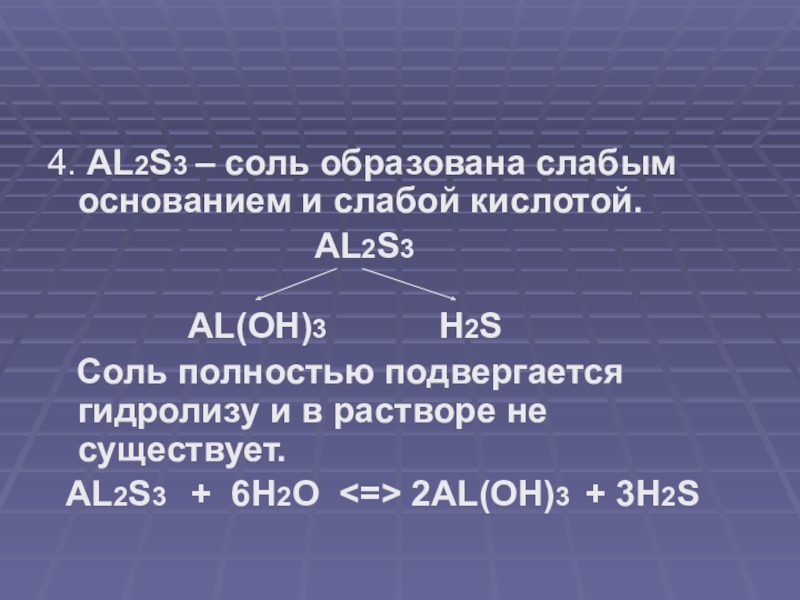
4. AL2S3 – соль образована слабым основанием и слабой кислотой.
AL2S3
AL(OH)3 H2S
Соль полностью подвергается гидролизу и в растворе не существует.
AL2S3 + 6H2O <=> 2AL(OH)3 + 3H2S
AL(OH)3 H2S
Соль полностью подвергается гидролизу и в растворе не существует.
AL2S3 + 6H2O <=> 2AL(OH)3 + 3H2S
Слайд 16Значение гидролиза
При гидролизе древесины, подсолнечной лузги, кукурузных кочерыжек, хлопковой шелухи
получают белковые дрожжи, этиловый и метиловый спирт, скипидар и многие другие вещества.
При гидролизе минералов в природе происходит разрушение горных пород.
При гидролизе минералов в природе происходит разрушение горных пород.
Слайд 17Значение гидролиза
Гидролиз некоторых солей используют для очистки воды и
уменьшения ее жесткости.
Процесс гидролиза лежит в основе многих производств: получение мыла из жиров, переработка древесины, засахаривание крахмала
Процесс гидролиза лежит в основе многих производств: получение мыла из жиров, переработка древесины, засахаривание крахмала
Слайд 18Домашнее задание
Записи выучить.
Расписать гидролиз солей:
а) CuSO4
б) K3PO4
в) Na2S
г) AL2(SO4)3
Слайд 19Проверка домашнего задания
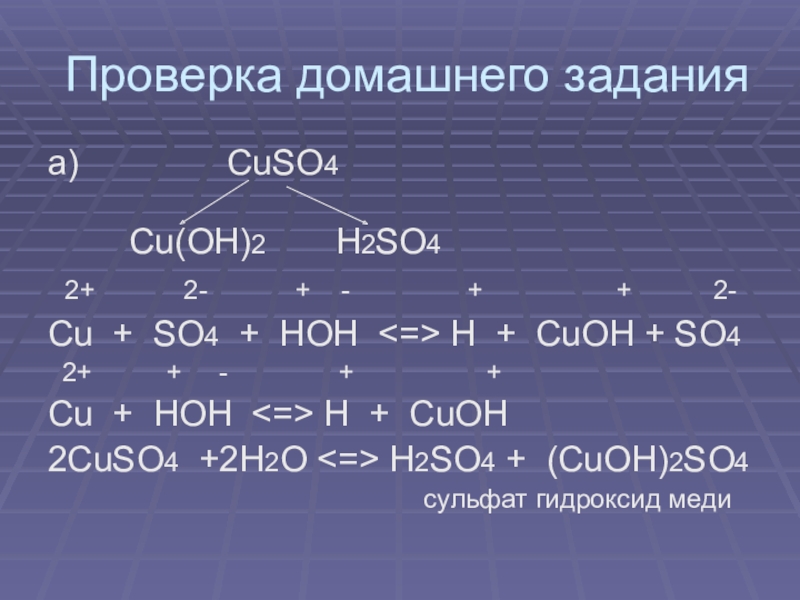
а) CuSO4
Cu(OH)2 H2SO4
2+ 2- + - + + 2-
Cu + SO4 + HOH <=> H + CuOH + SO4
2+ + - + +
Cu + HOH <=> H + CuOH
2CuSO4 +2H2O <=> H2SO4 + (CuOH)2SO4
сульфат гидроксид меди
2+ 2- + - + + 2-
Cu + SO4 + HOH <=> H + CuOH + SO4
2+ + - + +
Cu + HOH <=> H + CuOH
2CuSO4 +2H2O <=> H2SO4 + (CuOH)2SO4
сульфат гидроксид меди
Слайд 20
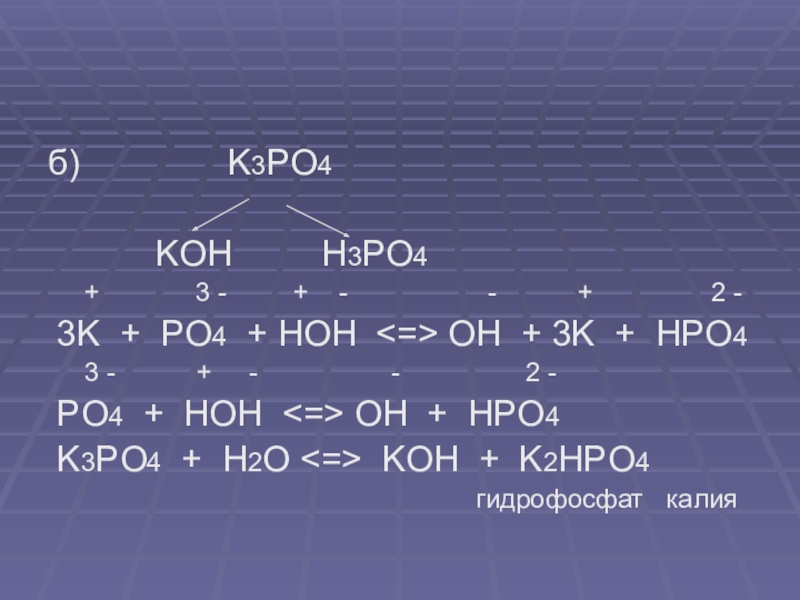
б) K3PO4
KOH H3PO4
+ 3 - + - - + 2 -
3K + PO4 + HOH <=> OH + 3K + HPO4
3 - + - - 2 -
PO4 + HOH <=> OH + HPO4
K3PO4 + H2O <=> KOH + K2HPO4
гидрофосфат калия
+ 3 - + - - + 2 -
3K + PO4 + HOH <=> OH + 3K + HPO4
3 - + - - 2 -
PO4 + HOH <=> OH + HPO4
K3PO4 + H2O <=> KOH + K2HPO4
гидрофосфат калия
Слайд 21
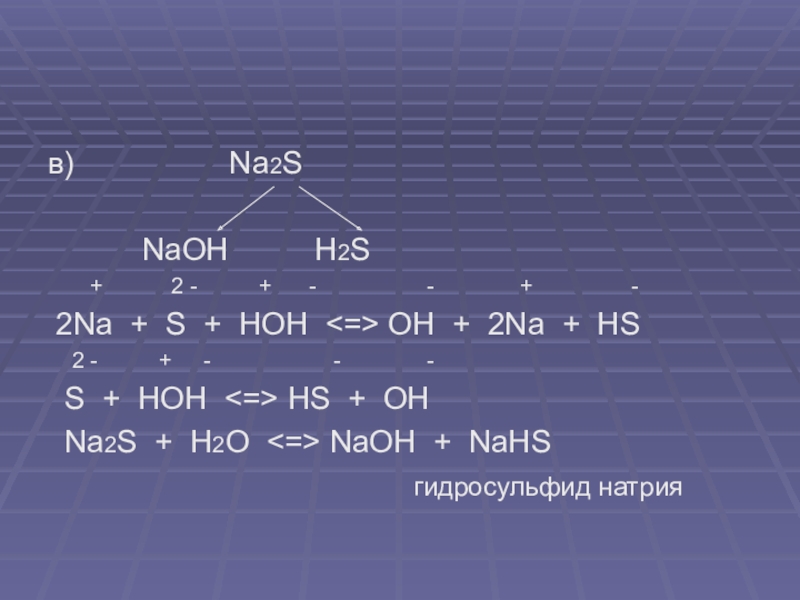
в) Na2S
NaOH H2S
+ 2 - + - - + -
2Na + S + HOH <=> OH + 2Na + HS
2 - + - - -
S + HOH <=> HS + OH
Na2S + H2O <=> NaOH + NaHS
гидросульфид натрия
+ 2 - + - - + -
2Na + S + HOH <=> OH + 2Na + HS
2 - + - - -
S + HOH <=> HS + OH
Na2S + H2O <=> NaOH + NaHS
гидросульфид натрия
Слайд 22
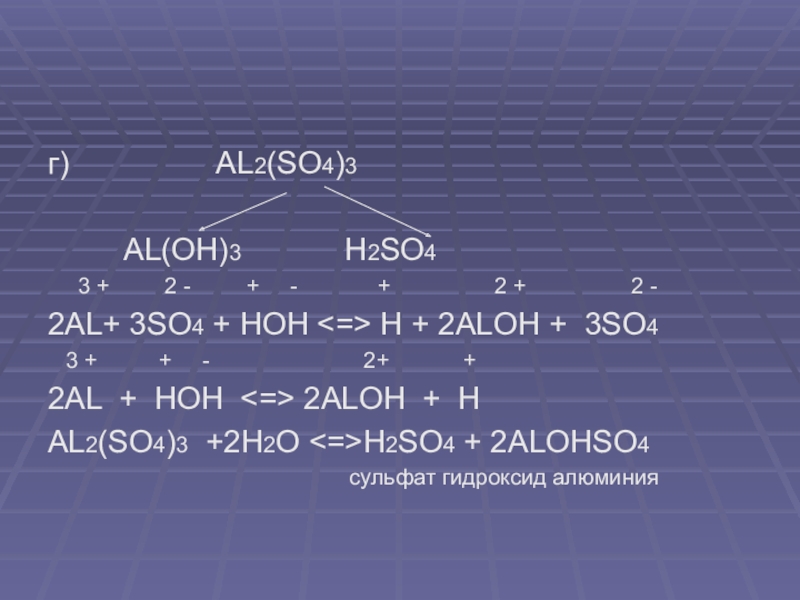
г) AL2(SO4)3
AL(OH)3 H2SO4
3 + 2 - + - + 2 + 2 -
2AL+ 3SO4 + HOH <=> H + 2ALOH + 3SO4
3 + + - 2+ +
2AL + HOH <=> 2ALOH + H
AL2(SO4)3 +2H2O <=>H2SO4 + 2ALOHSO4
сульфат гидроксид алюминия
3 + 2 - + - + 2 + 2 -
2AL+ 3SO4 + HOH <=> H + 2ALOH + 3SO4
3 + + - 2+ +
2AL + HOH <=> 2ALOH + H
AL2(SO4)3 +2H2O <=>H2SO4 + 2ALOHSO4
сульфат гидроксид алюминия
Слайд 23Расписать гидролиз солей
а) Li2CO3
б) ALCL3
в) Mg(NO3)2
г) Na3PO4
д) BaCO3
е) AL(NO3)3
ж) Cs2SO3
Слайд 24
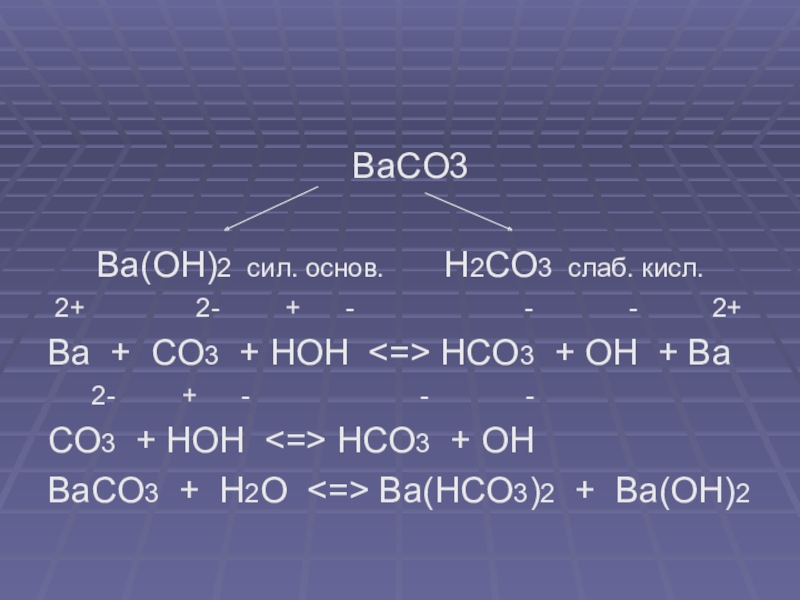
BaCO3
Ba(OH)2 сил. основ. H2CO3 слаб. кисл.
2+ 2- + - - - 2+
Ba + CO3 + HOH <=> HCO3 + OH + Ba
2- + - - -
CO3 + HOH <=> HCO3 + OH
BaCO3 + H2O <=> Ba(HCO3)2 + Ba(OH)2
Ba(OH)2 сил. основ. H2CO3 слаб. кисл.
2+ 2- + - - - 2+
Ba + CO3 + HOH <=> HCO3 + OH + Ba
2- + - - -
CO3 + HOH <=> HCO3 + OH
BaCO3 + H2O <=> Ba(HCO3)2 + Ba(OH)2
Слайд 25
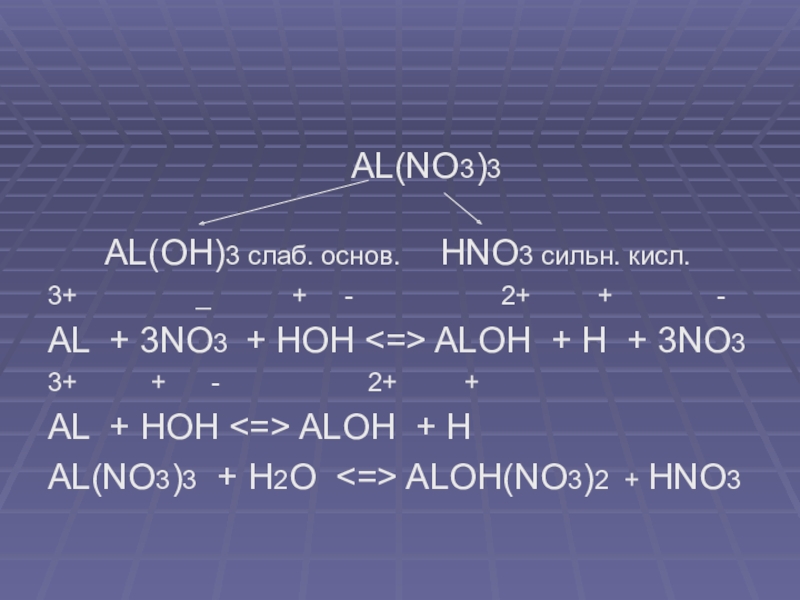
AL(NO3)3
AL(OH)3 слаб. основ. HNO3 сильн. кисл.
3+ _ + - 2+ + -
AL + 3NO3 + HOH <=> ALOH + H + 3NO3
3+ + - 2+ +
AL + HOH <=> ALOH + H
AL(NO3)3 + H2O <=> ALOH(NO3)2 + HNO3
AL(OH)3 слаб. основ. HNO3 сильн. кисл.
3+ _ + - 2+ + -
AL + 3NO3 + HOH <=> ALOH + H + 3NO3
3+ + - 2+ +
AL + HOH <=> ALOH + H
AL(NO3)3 + H2O <=> ALOH(NO3)2 + HNO3
Слайд 26
Cs2SO3
CsOH сил. основ. H2SO3 слаб. кисл.
+ 2 - + - - - +
2Cs + SO3 + HOH <=> HSO3 + ОH + 2Cs 2 - + - - -
SO3 + HOH <=> HSO3 + ОH
Cs2SO3 + H2O <=> CsHSO3 + CsOH
CsOH сил. основ. H2SO3 слаб. кисл.
+ 2 - + - - - +
2Cs + SO3 + HOH <=> HSO3 + ОH + 2Cs 2 - + - - -
SO3 + HOH <=> HSO3 + ОH
Cs2SO3 + H2O <=> CsHSO3 + CsOH