- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Гидролиз неорганических веществ
Содержание
- 1. Презентация по химии на тему Гидролиз неорганических веществ
- 2. Гидролиз – это химическая реакция взаимодействия вещества
- 3. Обратимый и необратимый гидролизобратимый: только небольшая часть
- 4. Обратимый и необратимый гидролизнеобратимый: практически все частицы
- 5. Г И Д Р О Л И
- 6. Слайд 6
- 7. Гидролиз солей1. Гидролиз по анионуГидролиз соли слабой
- 8. Гидролиз солей 2. Гидролиз по катиону. Гидролиз соли сильной
- 9. Гидролиз солей3.Гидролиз соли слабой кислоты и слабого
- 10. Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален
- 11. Гидролиз может проходить в несколько ступенейСтупенчатый гидролиз характерен
- 12. Слайд 12
Слайд 2 Гидролиз – это
химическая реакция взаимодействия вещества с водой, при которой
Слайд 3 Обратимый и необратимый гидролиз
обратимый: только небольшая часть частиц исходного вещества гидролизуется
2
Слайд 4Обратимый и необратимый гидролиз
необратимый: практически все частицы исходного вещества гидролизуются
Al₂S₃
Слайд 5
Г И Д Р О Л И З С О
Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита
Слайд 6 Гидролиз солей
Различают
1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону).
2.Гидролиз соли сильной кислоты и слабого основания (гидролиз
по катиону).
3. Гидролиз соли слабой кислоты и слабого основания
(необратимый).
Соль сильной кислоты и сильного основания не подвергается гидролизу
Слайд 7Гидролиз солей
1. Гидролиз по аниону
Гидролиз соли слабой кислоты и сильного основания
(раствор имеет щелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
Слайд 8Гидролиз солей
2. Гидролиз по катиону.
Гидролиз соли сильной кислоты и слабого основания
(раствор имеет кислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
Слайд 9
Гидролиз солей
3.Гидролиз соли слабой кислоты и слабого основания:
(гидролиз протекает практически полностью,
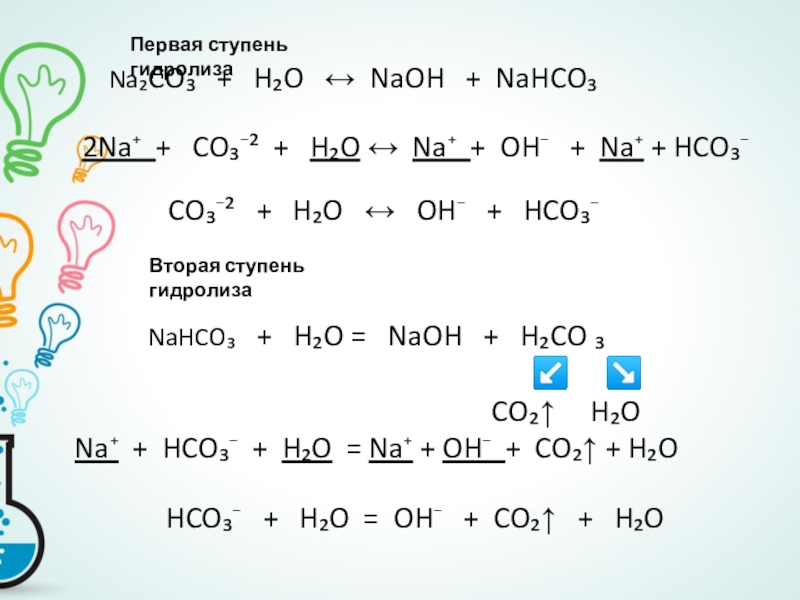
Слайд 11Гидролиз может проходить в несколько ступеней
Ступенчатый гидролиз характерен для солей, образованных слабым
Слайд 12
2Na⁺ + CO₃⁻² + H₂O ↔ Na⁺ + OH⁻ + Na⁺ + HCO₃⁻
CO₃⁻² + H₂O ↔ OH⁻ + HCO₃⁻
Первая ступень гидролиза
Вторая ступень гидролиза
NaHCO₃ + H₂O = NaOH + H₂CO ₃
↙ ↘
CO₂↑ H₂O
Na⁺ + HCO₃⁻ + H₂O = Na⁺ + OH⁻ + CO₂↑ + H₂O
HCO₃⁻ + H₂O = OH⁻ + CO₂↑ + H₂O