- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Галогены (9 класс)
Содержание
- 1. Презентация по химии на тему Галогены (9 класс)
- 2. Общая характеристика элементов VII А группы
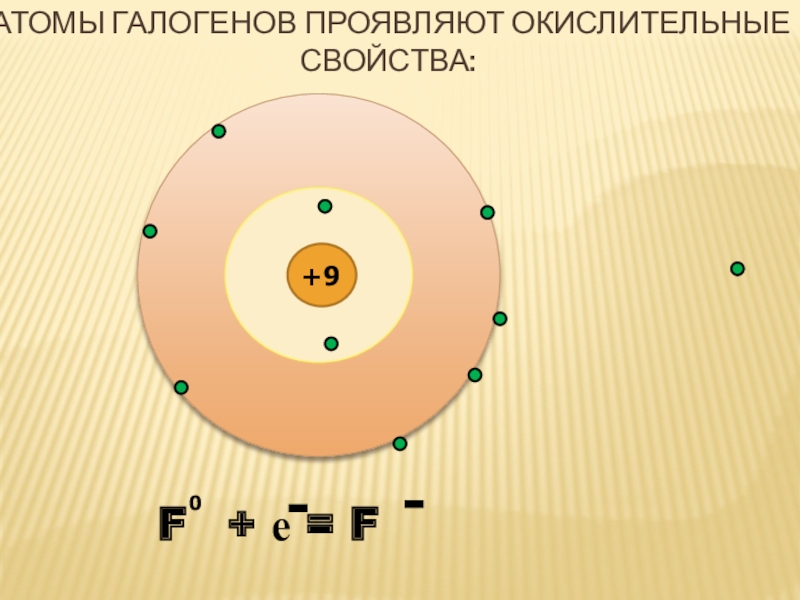
- 3. F + е = F +90--Атомы галогенов проявляют окислительные свойства:
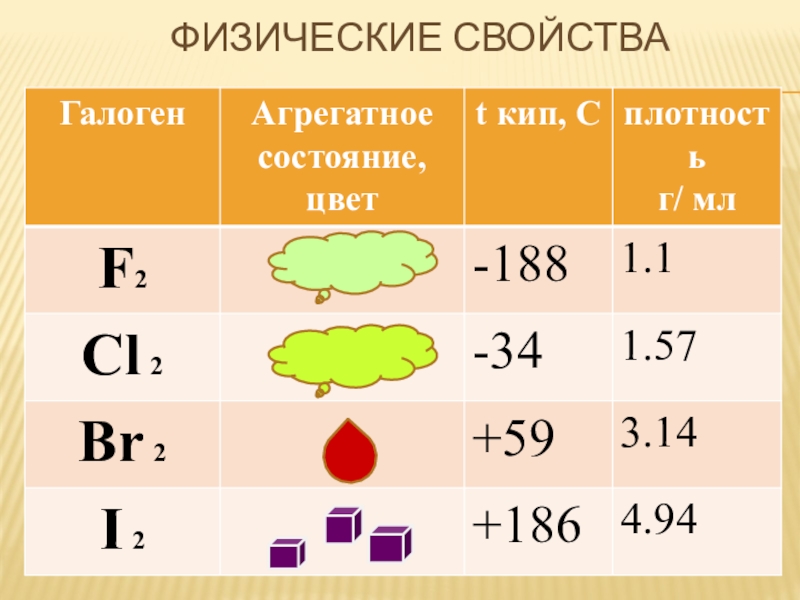
- 4. Физические свойства
- 5. Возгонка йодаI2Возгонка – это переход вещества при нагревании из твердого состояния в газообразное,минуя жидкое
- 6. Все галогены обладают очень резким запахом. Вдыхание
- 7. Характеристика галогенов
- 8. Периодическая система химических элементов Д.И.Менделеева1234567периодыГруппы элементовIIIIIIIVVVIVIIVIII0+17--Cl- Сl (75.5%), Cl (24.5%)3537
- 9. ПОЛУЧЕНИЕВ промышленности: NaCl = Cl2 +
- 10. С металлами:2Na + Cl2 = 2NaCl2. С
- 11. 3. С водой: Cl2 +
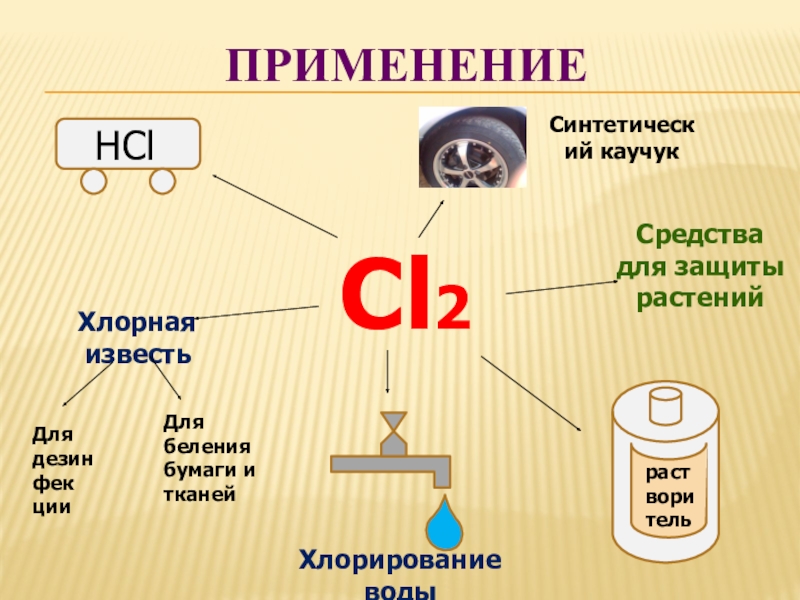
- 12. Средства для защиты растенийХлорная известьХлорирование водыСинтетический каучукПРИМЕНЕНИЕHClрастворительCl2Для дезинфекцииДля беления бумаги и тканей
Слайд 2Общая характеристика элементов VII А группы
F )2)7
Cl
Br )2)8)18)7
I )2)8)18)18)7
At )2)8)18)32)18)7
+9
+17
+35
+82
+53
Сходства:
7 е на внешнем
уровне
2. Строение внешнего
уровня
…
ns 2 np 5
3. Min степ. ок-я: -1
4. ЛВС: НЭ
Отличия:
Увеличивается заряд ядра;
2. Увеличивается число энергетических уровней;
3. Увеличивается радиус
атома;
4. Уменьшается притяжение
к ядру внешних е;
5. Неметаллические свойства ослабевают, металлические усиливаются
Слайд 5Возгонка йода
I2
Возгонка – это переход вещества при нагревании из твердого состояния
минуя жидкое
Слайд 6Все галогены обладают очень резким запахом. Вдыхание их даже в небольших
ЯД!
Слайд 8Периодическая система химических элементов Д.И.Менделеева
1
2
3
4
5
6
7
периоды
Группы элементов
I
II
III
IV
V
VI
VII
VIII
0
+17
-
-
Cl
-
Сl (75.5%), Cl
35
37
Слайд 9ПОЛУЧЕНИЕ
В промышленности:
NaCl = Cl2 + Na
2. В лаборатории:
HCl
2
2
4
2
Слайд 10С металлами:
2Na + Cl2 = 2NaCl
2. С неметаллами (кроме кислорода, азота,
H2 + Сl2 = 2 HCl
Si + 2 Cl2 = SiCl4
Химические свойства хлора
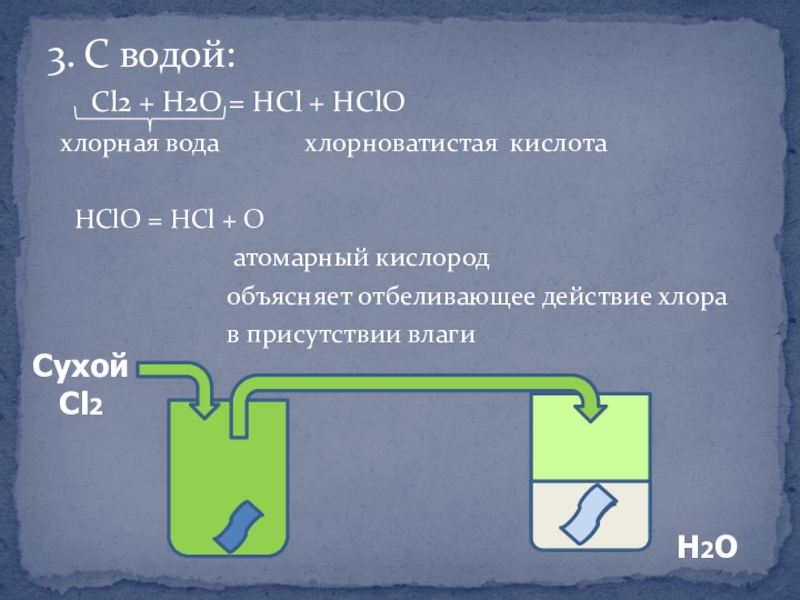
Слайд 113. С водой:
Cl2 + H2O = HCl +
хлорная вода хлорноватистая кислота
HClO = HCl + O
атомарный кислород
объясняет отбеливающее действие хлора
в присутствии влаги
Сухой
Cl2
H2O