- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Галогены
Содержание
- 1. Презентация по химии на тему: Галогены
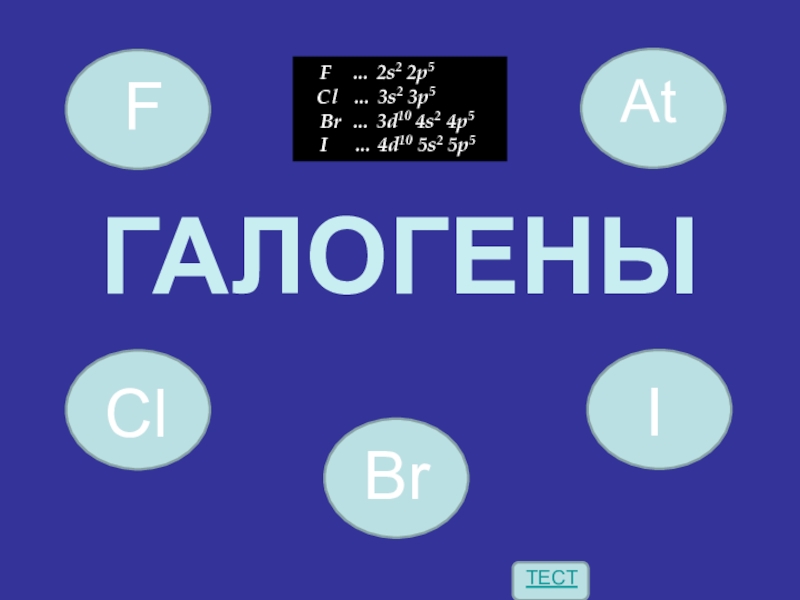
- 2. ГАЛОГЕНЫ F … 2s2 2p5
- 3. Фтор – от греческого «фторос» – что
- 4. Славу этого открытия и звание лауреата Нобелевской
- 5. Флюорит или плавиковый шпат (CaF2) – основной
- 6. Слайд 6
- 7. В качестве «рабочего вещества» применяются в холодильных
- 8. Соединения фтора применяются в ракетной технике как
- 9. Слайд 9
- 10. Х л о рЭтот газ Гэмфри Дэви,
- 11. Содержание элемента хлора в земной коре составляет
- 12. Наиболее распространённый способ обеззараживания питьевой воды -
- 13. В металлургии соединения хлора применяются для
- 14. Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений
- 15. Слайд 15
- 16. Б р о м «Точь-в-точь
- 17. В свободном состоянии бром не встречается из-за
- 18. Бромид натрия – незаменимая добавка к дубителям
- 19. Слайд 19
- 20. Й о дЙод был открыт в
- 21. Йод не образует самостоятельных месторождений, его содержание
- 22. В организме человека йод входит в состав
- 23. Слайд 23
- 24. Соединения йода особенно широко применяются в медицине
- 25. Иодные лампы применяются для освещения больших
- 26. Слайд 26
- 27. А С Т А ТАстат – второй
- 28. Астат был открыт в 1940 году итальянским
- 29. Вопрос № 1«Вездесущий» – так назвал этот галоген академик А.Е. Ферсман
- 30. Вопрос № 2Этот галоген назвали «всесъедающий», хотя он входит в состав зубной эмали
- 31. Вопрос № 3Галоген, возможность существования которого предсказал Д.И. Менделеев
- 32. Вопрос № 4 В природе галогены встречаются в виде
- 33. Вопрос № 5 Как изменяется радиус атомов галогенов с увеличением относительной атомной массы?
- 34. Задание на дом Учебник химии для 9 класса §17, стр.78-79, §19, задача 3
- 35. ЛИТЕРАТУРА 1. Книга для чтения по неорганической
Слайд 3Фтор – от греческого «фторос» –
что означает разрушение, гибель.
Ф
Когда Муассан докладывал Парижской академии наук о своем открытии, один глаз ученого был закрыт черной повязкой
В 1886 году Анри Муассану удалось получить фтор электролизом безводного фторида водорода и в 1906 году ему была присуждена Нобелевская премия
Слайд 4Славу этого открытия и звание лауреата Нобелевской премии по праву должны
Слайд 5Флюорит или плавиковый шпат (CaF2) – основной минерал, содержащий фтор, так
криолита Na3 AlF6
Фтор также входит в состав фторапатита 3Ca(PO4 ) 2 *CaF2 ,
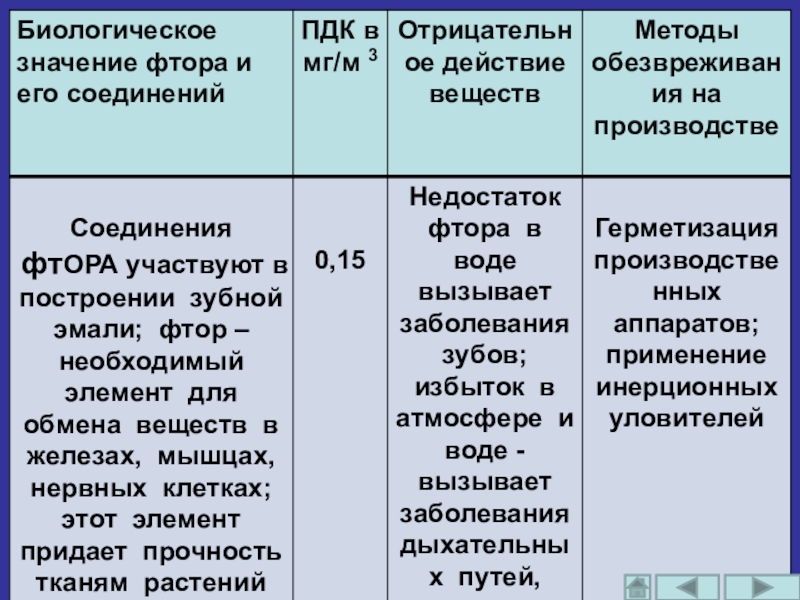
Содержание фтора (элемента) в земной коре составляет 6,25 * 10 -2 от общей массы.
Слайд 7В качестве «рабочего вещества» применяются в холодильных установках фреоны CCl2F2 -
Тефлон более устойчив к агрессивным средам, чем золото и платина, хотя в его составе более 75% самого агрессивного из галогенов - фтора
Фтор входит в состав не только хладоагентов, лекарств, ядохимикатов, но и в состав искусственной крови, полимеров, красителей
Слайд 8Соединения фтора применяются в ракетной технике как окислитель ракетного топлива
Соединения фтора
Шестифтористая сера SF6 — газообразный изолятор в электротехнической промышленности
Криолит 3 NaF *AlF3 сделал промышленное производство алюминия доступным и дешевым, понижая температуру плавления оксида алюминия
Слайд 10Х л о р
Этот газ Гэмфри Дэви, английский химик, в 1810
В свободном состоянии хлор впервые был получен в 1774 году шведским химиком Карлом Вильгельмом Шееле
MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
Современное название этому газу «хлор» дал в 1812 году французский химик Гей-Люссак
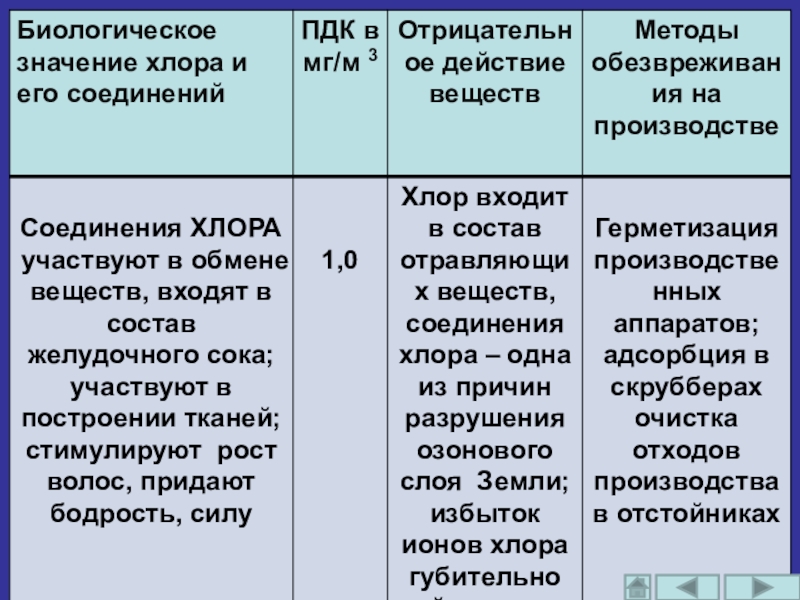
Слайд 11Содержание элемента хлора в земной коре составляет 1,7*10 -2 по массе.
галита (каменной соли) NaCl,сильвинита KCl *NaCl, бишофита MgCl 2 * 2H 2 O
карналлита KCl*NgCl 2*6H2O , каинита KCl*MgSO 4 *3H2O
Слайд 12Наиболее распространённый способ обеззараживания питьевой воды - хлорирование - основан на
В пищевой промышленности зарегистрирован в качестве пищевой добавки E 925
Слайд 13
В металлургии соединения хлора применяются для производства чистых металлов: титана,
Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты: Cl2 + H2O → HCl + HClO → 2HCl + O•
Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков
Слайд 14Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные
Слайд 16Б р о м
«Точь-в-точь как ртуть есть
Слайд 17В свободном состоянии бром не встречается из-за высокой химической активности
Самый известный
Морская вода – главный источник рассеянного элемента – брома. В организме человека больше всего брома содержится в мозге, а среди растений больше всего накапливают бром бобовые и морские водоросли
Слайд 18Бромид натрия – незаменимая добавка к дубителям в кожевенном производстве
Из прозрачных
Бромид серебра стал первоосновой для изготовления фотопленки, кинопленки, фотобумаги
Успокаивающие препараты также содержат соединения брома.
Широко применяются тетраброминдиго –стойкий синий , диброминдиго – красный , красители
Слайд 20Й о д
Йод был открыт в 1811 году французским химиком-технологом
2 NaI + 2 H2SO4 = I2 + SO2 + Na2 SO4 + 2 H2 O
Название элемента происходит от греческого «iodes, ioeides» – похожий на фиалку, фиолетовый.
Слайд 21Йод не образует самостоятельных месторождений, его содержание в земной коре составляют
«ЙОД вездесущий» – писал о нем академик А.Е.Ферсман, так как невозможно назвать вещество, в котором бы современные методы анализа не открыли бы присутствия хотя бы незначительных следов йода.
Слайд 22В организме человека йод входит в состав белка тиреоглобулина, содержащегося в
Недостаток йода у взрослых людей вызывает зобную болезнь , а в детском возрасте нехватка йода приводит
к развитию страшной болезни – кретинизму.
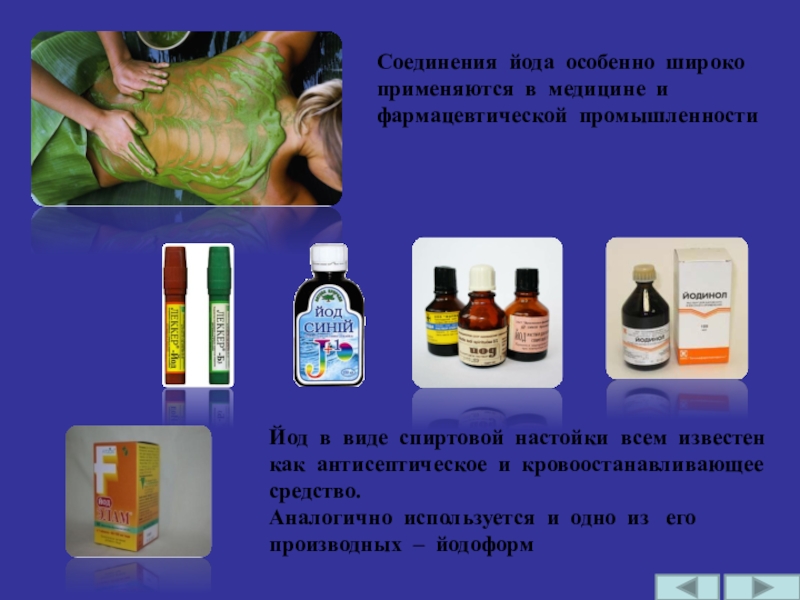
Слайд 24Соединения йода особенно широко применяются в медицине и фармацевтической промышленности
Йод в
Аналогично используется и одно из его производных – йодоформ
Слайд 25
Иодные лампы применяются для освещения больших площадей и стадионов.
Для сварки
Кристаллы иодида серебра, распыляемые над облаками, искусственно вызывают дождь.
Слайд 27А С Т А Т
Астат – второй после технеция искусственный элемент,
Возможность его существования была предсказана Д.И.Менделеевым. Ученый именовал последний галоген не только экаиодом, но и галоидом X.
Он писал в 1898 г.: «Можно, например, сказать, что при открытии галоида X с атомным весом, большим, чем иод, он все же будет образовывать KX, KXO3 и т.п., что его водородное соединение будет газообразной, очень непрочной кислотой, что атомный весь будет... около 215».
Слайд 28Астат был открыт в 1940 году итальянским физиком Эмилио-Джино Сегре вместе
Для получения астата ученые использовали ядерную реакцию, в которой ядра висмута подвергались бомбардировке ядрами гелия:
В переводе с греческого «астатос» означает – неустойчивый, самый долгоживущий изотоп астата имеет период полураспада всего 8,3 часа, то есть от полученного утром астата к вечеру не останется и половины.
В земной коре в каждый данный момент времени находится не более 30 г астата.
20983Bi + 42He → 21185At + 2 10n
Слайд 33
Вопрос № 5
Как изменяется радиус атомов галогенов с увеличением относительной
Слайд 35
ЛИТЕРАТУРА
1. Книга для чтения по неорганической химии. Ч.1. Пособие для
2. Химия. 9 класс: Настольная книга для учителя / О.С.Габриелян, И.О.Остроумов. – 2-е изд., стереотип. – М.: Дрофа, 2003. – С. 97-105.
3. Попова Н.А. Из опыта изучения подгруппы галогенов // Химия в школе – 2011 - №6.
4. Интернет-ресурсы
5. Енякова Т.М. Внеклассная работа по химии. –М.: Дрофа,2004.-С.115-125.
6. Нестандартные уроки химии. 8-9 классы./Сост. С.В. Бочарова. – Волгоград: ИТД «Корифей»,2006.-80 с.