завершения октета им не хватает всего лишь одного электрона.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
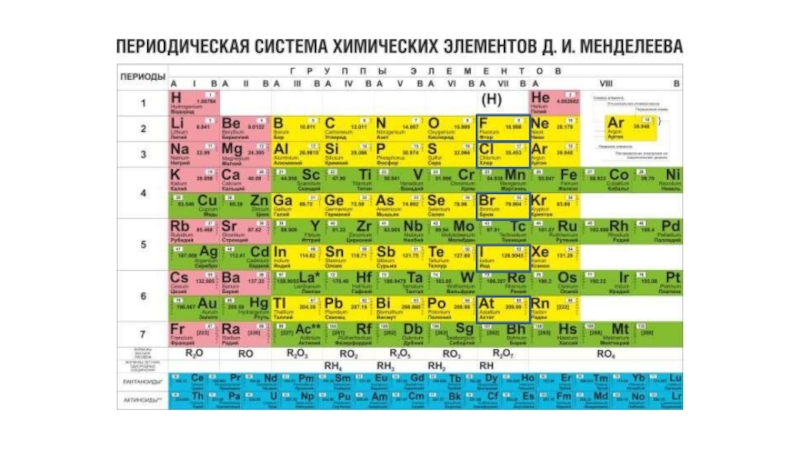
Презентация, доклад по химии на тему: Галогены
Содержание
- 1. Презентация по химии на тему: Галогены
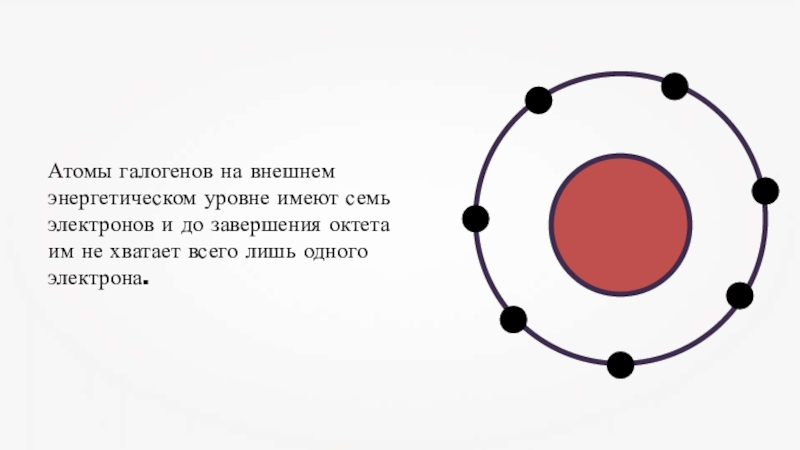
- 2. Атомы галогенов на внешнем энергетическом уровне имеют
- 3. Галогены являются очень сильными окислителями. Фтор в
- 4. АстатинПростые вещества галогены представляют собой двухатомныемолекулы, образующиеся за счёт ковалентной неполярной связи.
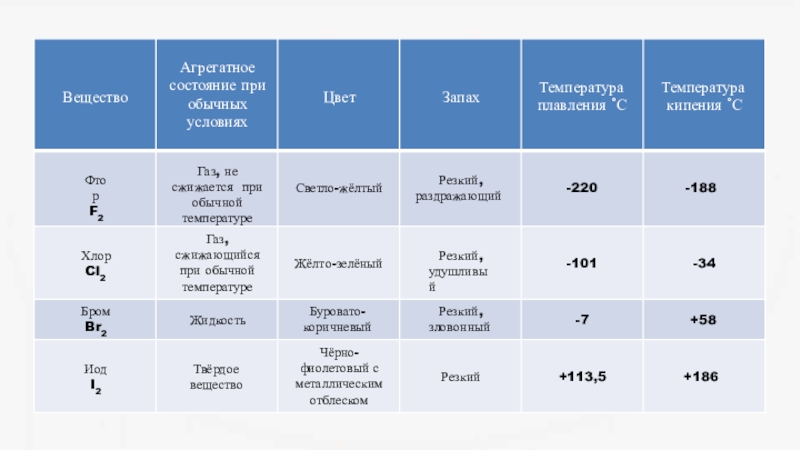
- 5. Слайд 5
- 6. Хлорная водаБромная вода
- 7. Химические свойства галогеновВзаимодействие галогенов с металлами:2Ag +
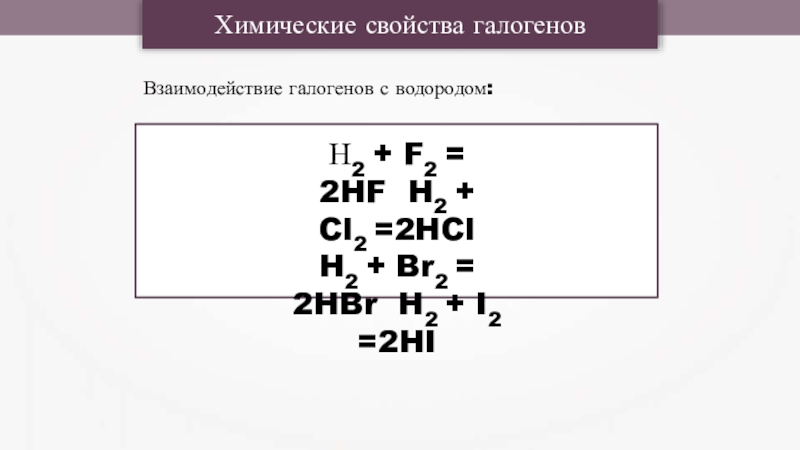
- 8. Химические свойства галогеновВзаимодействие галогенов с водородом:Н2 +
- 9. Химические свойства галогеновВзаимодействие галогенов со сложными веществами:Cl2
- 10. Анри Муассан 1852–1907 гг.Французский химик. Впервые получил
- 11. Шведский химик. Открыл хлор в 1774 г.
- 12. Антуан Баларом1802–1876 гг.Французский химик. Открыл бром в
- 13. Бернар Куртуа1777–1838 гг.Французский учёный. В 1811 г.
Атомы галогенов на внешнем энергетическом уровне имеют семь электронов и до завершения октета им не хватает всего лишь одного электрона.
Слайд 3Галогены являются очень сильными окислителями. Фтор в химических реакциях проявляет только
окислительные свойства, и для него характерна степень окисления
-1 в соединениях. Все остальные галогены могут проявлять ещё и восстановительные свойства при взаимодействии с более электроотрицательными элементами, такими как кислород, азот, принимая значения степени окисления +1, +3, +5
или +7.
-1 в соединениях. Все остальные галогены могут проявлять ещё и восстановительные свойства при взаимодействии с более электроотрицательными элементами, такими как кислород, азот, принимая значения степени окисления +1, +3, +5
или +7.
Слайд 4Астатин
Простые вещества галогены представляют собой двухатомные
молекулы, образующиеся за счёт ковалентной неполярной
связи.
Слайд 7Химические свойства галогенов
Взаимодействие галогенов с металлами:
2Ag + F2 = 2AgF
2Fe +
3Cl2 = 2FeCl3
Cu + Br2 = CuBr2 2Al +3I2 = 2AlI3
Cu + Br2 = CuBr2 2Al +3I2 = 2AlI3
Слайд 8Химические свойства галогенов
Взаимодействие галогенов с водородом:
Н2 + F2 = 2HF H2
+ Cl2 =2HCl H2 + Br2 = 2HBr H2 + I2 =2HI
Слайд 9Химические свойства галогенов
Взаимодействие галогенов со сложными веществами:
Cl2 + 2NaBr = 2NaCl
+ Br2 Cl2 + 2KI = 2KCl + I2
2F2 + 2H2O = 4HF + O2
2F2 + 2H2O = 4HF + O2
Слайд 10Анри Муассан 1852–1907 гг.
Французский химик. Впервые получил фтор в свободном виде
в 1886 г., за что был удостоен Нобелевской премии. Название фторос, что в переводе с греческого значит «разрушающий», было дано из-за большой токсичности фтора.
Слайд 11Шведский химик. Открыл хлор в 1774 г. Такое название хлор
получил благодаря
цвету простого вещества, в переводе с греческого хлорос значит «жёлто-зелёный».
Карл Шееле
1852–1907 гг.
Слайд 12Антуан Баларом
1802–1876 гг.
Французский химик. Открыл бром в 1826 г. В переводе
с греческого бромос значит «зловонный», что в действительности соответствует невыносимому запаху простого вещества брома.
Слайд 13Бернар Куртуа
1777–1838 гг.
Французский учёный. В 1811 г. получил йод. Своё название
йод получил за свою фиолетовую окраску (в переводе с греческого
«иодэс» означает фиолетовый).
«иодэс» означает фиолетовый).