- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
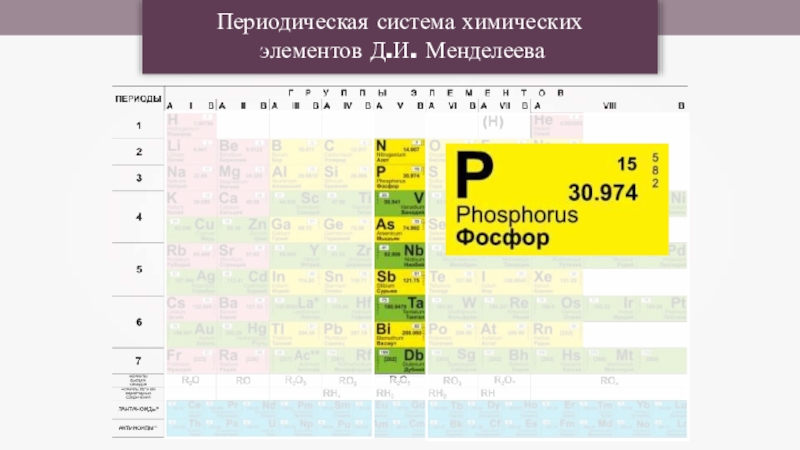
Презентация, доклад по химии на тему: Фосфор и его соединения
Содержание
- 1. Презентация по химии на тему: Фосфор и его соединения
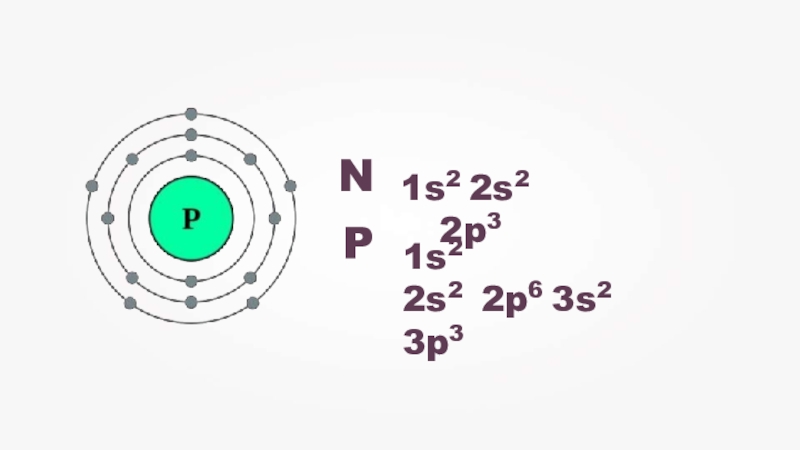
- 2. 1s2 2s2 2p3N P1s2
- 3. В соединениях фосфор способен проявлять степень окисления
- 4. Аллотропные модификации фосфораMaterialscientist
- 5. Белый фосфорБелый фосфор представляет собой легкоплавкое, летучее вещество, нерастворимое в воде, но хорошо растворимое в сероуглероде.
- 6. Белый фосфорБелый фосфор очень ядовит, легко окисляется
- 7. Красный фосфорКрасный фосфор — порошкообразное вещество тёмно-красного
- 8. Красный фосфор
- 9. Чёрный фосфорПоджечь чёрный фосфор можно, только предварительно
- 10. Красный и черный фосфор обладают очень сложной
- 11. Белый фосфор и красный фосфор обладают схожими химическими свойствами, однако белый обладает большей реакционной способностью.
- 12. При взаимодействии фосфора с металлами образуются фосфиды.2Р + 3Са = Са3Р2
- 13. Окисление фосфора кислородом4Р + 5О2 = 2Р2О5
- 14. Получение фосфина РН3Са3Р2 + 6НСl = 3CaCl2 + 2PH3↑
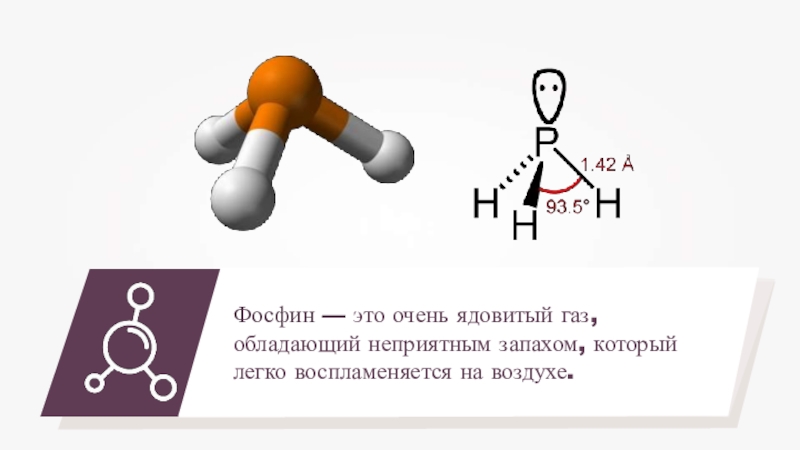
- 15. Фосфин — это очень ядовитый газ, обладающий неприятным запахом, который легко воспламеняется на воздухе.
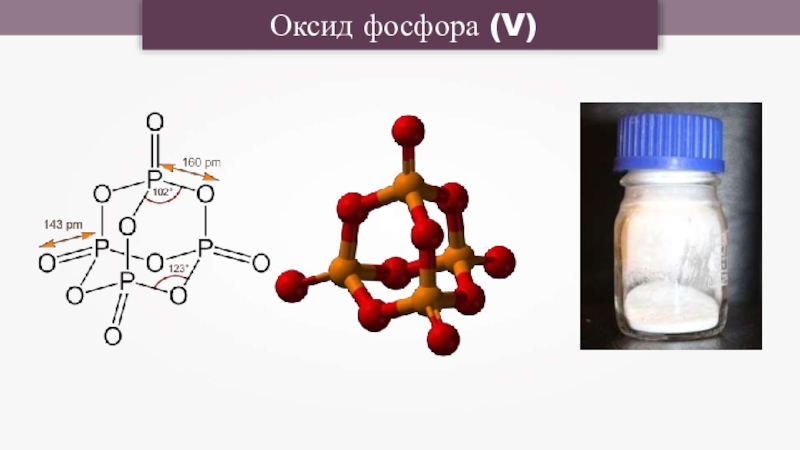
- 16. Оксид фосфора (V)
- 17. Химические свойства Р2О51.Взаимодействует с водой с образованием
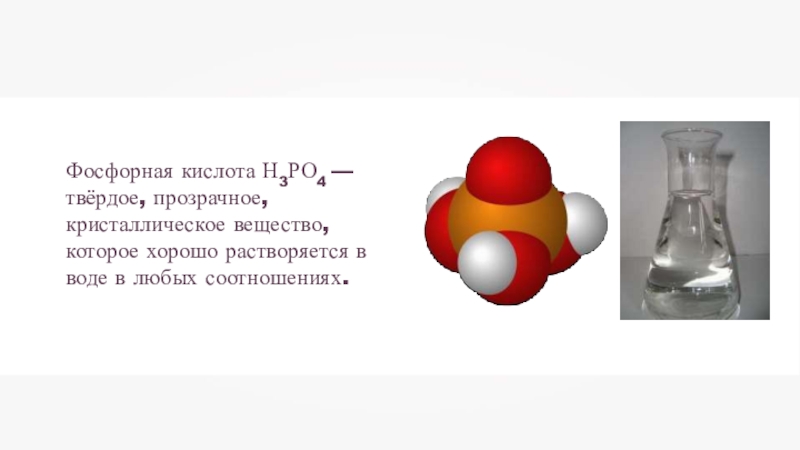
- 18. Фосфорная кислота Н3РО4 — твёрдое, прозрачное, кристаллическое вещество, которое хорошо растворяется в воде в любых соотношениях.
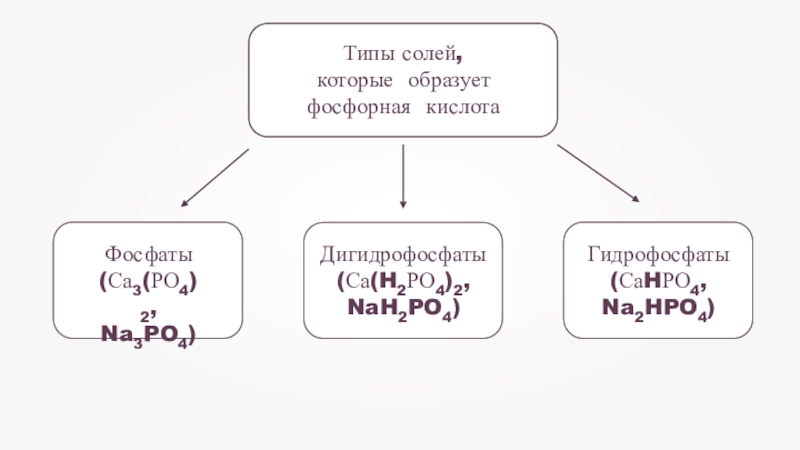
- 19. Фосфаты (Са3(РО4)2, Na3PO4)Гидрофосфаты (СаHРО4, Na2HPO4)Дигидрофосфаты (Са(H2РО4)2, NaH2PO4)Типы солей, которые образует фосфорная кислота
- 20. Качественным реактивом на фосфаты РО43- является нитрат серебра AgNO3.43-3 4РО + 3Ag = Ag PO ↓жёлтый осадок+
- 21. Фосфор в природеФосфоритыАпатитыФосфор в природе
- 22. В промышленности фосфор получают из наиболее часто встречающегося фосфата кальция Ca3(PO4)2.
- 23. P
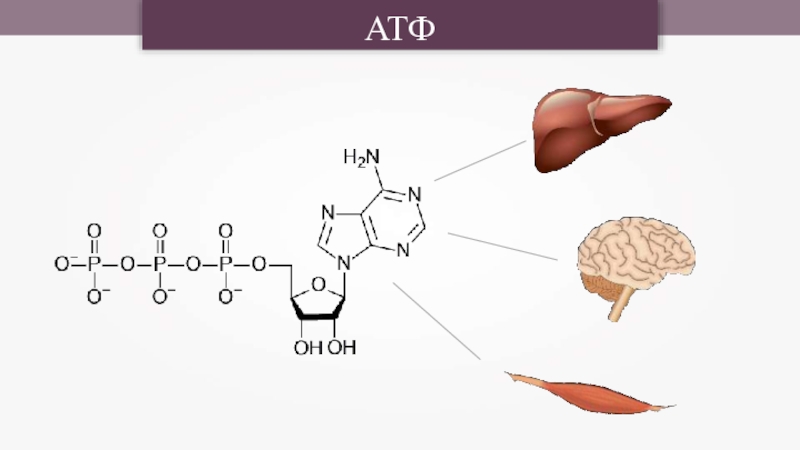
- 24. АТФ
- 25. ДНКРНК
- 26. Слайд 26
- 27. Схема круговорота фосфора в природеPPPPPPPPPPP
- 28. Применение фосфораСпичкиФосфорная кислота
- 29. Г. Бранд 1630–1710 гг.Фосфор был открыт в
1s2 2s2 2p3N P1s2 2s2 2p6 3s2 3p3
Слайд 3В соединениях фосфор способен проявлять степень окисления –3
(в соединениях фосфора с
металлами — фосфидах), но чаще всего он проявляет свою максимальную положительную степень окисления +5,
реже +3.
реже +3.
Слайд 5Белый фосфор
Белый фосфор представляет собой легкоплавкое, летучее вещество, нерастворимое в воде,
но хорошо растворимое в сероуглероде.
Слайд 6Белый фосфор
Белый фосфор очень ядовит, легко окисляется на воздухе. Особым его
свойством является способность светиться в темноте вследствие его окисления.
Слайд 7Красный фосфор
Красный фосфор — порошкообразное вещество тёмно-красного цвета, без запаха,
не растворяется
в воде и сероуглероде, не ядовит.
Окисление красного фосфора на воздухе протекает очень медленно, самовоспламеняться он не способен, в темноте не светится.
Окисление красного фосфора на воздухе протекает очень медленно, самовоспламеняться он не способен, в темноте не светится.
Слайд 9Чёрный фосфор
Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере
чистого кислорода до 400 °С.
Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника.
Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника.
Слайд 10Красный и черный фосфор обладают очень сложной структурой, поэтому в уравнениях
реакций их формулу записывают просто Р.
Р
Слайд 11Белый фосфор и красный фосфор обладают схожими химическими свойствами, однако белый
обладает большей реакционной способностью.
Слайд 15Фосфин — это очень ядовитый газ, обладающий неприятным запахом, который легко
воспламеняется на воздухе.
Слайд 17Химические свойства Р2О5
1.Взаимодействует с водой с образованием кислоты:
Р2О5 + 3Н2О =
2Н3РО4
Взаимодействует с основными оксидами с образованием солей – фосфатов:
Р2О5 + 3СаО = Са3(РО4)2
Взаимодействует с основаниями с
образованием соли и воды:
Р2О5 + 3Са(ОН)2 = Са3(РО4)2 + 3Н2О
Взаимодействует с основными оксидами с образованием солей – фосфатов:
Р2О5 + 3СаО = Са3(РО4)2
Взаимодействует с основаниями с
образованием соли и воды:
Р2О5 + 3Са(ОН)2 = Са3(РО4)2 + 3Н2О
Слайд 18Фосфорная кислота Н3РО4 — твёрдое, прозрачное, кристаллическое вещество, которое хорошо растворяется
в воде в любых соотношениях.
Слайд 19Фосфаты (Са3(РО4)2, Na3PO4)
Гидрофосфаты (СаHРО4, Na2HPO4)
Дигидрофосфаты (Са(H2РО4)2, NaH2PO4)
Типы солей, которые образует фосфорная
кислота
Слайд 20Качественным реактивом на фосфаты РО43- является нитрат серебра AgNO3.
4
3-
3 4
РО + 3Ag =
Ag PO ↓
жёлтый осадок
+
Слайд 22В промышленности фосфор получают из наиболее часто встречающегося фосфата кальция Ca3(PO4)2.
Слайд 29Г. Бранд 1630–1710 гг.
Фосфор был открыт в 1669 г. немецким алхимиком
Г. Брандом, а своё название получил за способность светиться в темноте, в переводе с греческого фосфор означает «светоносный».