- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Фосфор - элемент жизни и мысли
Содержание
- 1. Презентация по химии на тему Фосфор - элемент жизни и мысли
- 2. Цели урока: 1. Повторить строение атома, аллотропию
- 3. А вот собака мчится.О, ужас! Не смотри!Во
- 4. Положение в ПСХЭР – элемент V-A группы,
- 5. Открытие фосфораВ 1669 г. гамбурский алхимик Хенниг
- 6. Происхождение названияФосфор обозначает светоносецпроисходит от греческих слов:
- 7. Содержание фосфора в природеФосфор находится во всех
- 8. Слайд 8
- 9. Фосфор в организме человекаВ организме взрослого человека
- 10. Правильное питаниеНеобходимо соблюдать баланс между количеством потребляемого
- 11. Ежедневная норма РЕжедневная норма человеческого организма в
- 12. Аллотропные модификацииБелый фосфор (Х.Бранд – 1669 г.)Коричневый
- 13. Работа в группе Аллотропные модификации. Что такое
- 14. Кристаллические решётки Белый фосфор(молекулярная)2) Красный фосфор (атомная)От вида кристаллической решетки зависят свойства фосфора
- 15. Белый и красный фосфор
- 16. Свеча, загорающаяся самаДелается это так: на фитиль
- 17. Свойства фосфораРабота с учебникомСтр.160
- 18. 1. Какое?
- 19. 2.Взаимодействие с металлами.
- 20. Применение фосфора
- 21. Слайд 21
- 22. СпичкиПервые спички были созданы в 1827 г. Они
- 23. Шведские спичкиПромышленное производство безопасных спичек началось в
- 24. Холодное «химическое» свечениеСвечение паров белого фосфора послужило
- 25. Заколдованные алмазыНа фоне черного бархата в запаянной
- 26. Через час жулики были в номере гостиницы
- 27. Чернобородый с проклятиями заметался по комнате, потом
- 28. Вечером того же дня в городскую больницу
- 29. Через два дня профессор, сильно расстроенный похищением
- 30. А вот собака мчится.О, ужас! Не смотри!Во
- 31. Слайд 31
Слайд 1Фосфор –
«элемент
жизни и мысли»
А.Е.Ферсман
Учитель химии МОУ СОШ №
Сараева Галина Романовна
Слайд 2Цели урока:
1. Повторить строение атома, аллотропию и сравнительные характеристики аллотропных
2. Рассмотреть химические свойства фосфора
Обучающие:
1. Изучить свойства и значения фосфора и его соединений
2. Совершенствовать умения учащихся применять полученные знания для характеристики элемента по его положению в ПС.
Развивающие:
1. Развивать умение учащихся формулировать гипотезу и проводить опытную проверку , опираясь на знания химии.
Воспитательные:
1. Способствовать формированию взгляда учащихся о познаваемости мира;
2. Воспитывать бережно отношение к окружающей среде.
Слайд 3
А вот собака мчится.
О, ужас! Не смотри!
Во тьме она светится,
В
Но, кто же ты? Ответь нам.
И где тебя найти?
Стою в ряду я третьем,
Ты там меня ищи.
Слайд 4Положение в ПСХЭ
Р – элемент V-A группы,
порядковый номер 15, Аr
высшая валентность = V,
низшая – III, формула высшего оксида Р2О5 , летучего водородного соединения РН3.
Строение атома: протонов – 15, электронов –15, нейтронов –16.Схема строения атома: 31 15 Р 2, 8, 5.
Электронная формула:
1s2 2s2 2 p6 3s2 3 p3 3 d0
Слайд 5Открытие фосфора
В 1669 г. гамбурский алхимик Хенниг Бранд открыл белый фосфор.
Открытие
Слайд 6Происхождение названия
Фосфор обозначает светоносец
происходит от греческих слов:
«фос» - свет,
Название «фосфóры» приписывают всем веществам, светящимся в темное после предварительного облучения,
а само явление холодного свечения называют фосфоресценцией.
Слайд 7Содержание фосфора в природе
Фосфор находится во всех частях зеленых растений, которые
Слайд 8
Данная тема имеет прикладное значение.
На всех этапах урока проводится взаимосвязь с жизнью.
Слайд 9Фосфор в организме человека
В организме взрослого человека содержание фосфора около 750
в том числе в костях – 700 г,
мозг – 6 г,
мышцы – 65 г.
Самое твердое вещество – зубная эмаль по составу соответствует фторапатиту
Слайд 10Правильное питание
Необходимо соблюдать баланс между количеством потребляемого
фосфора и кальция:
Их
1,5 : 1.
Избыток богатой фосфором пищи приводит к вымыванию кальция из костей, а при избытке кальция развивается мочекаменная болезнь.
Слайд 11Ежедневная норма Р
Ежедневная норма человеческого организма в фосфоре составляет 1,2 г.
Основное его количество мы потребляем с молоком и хлебом.
В 100 г хлеба содержится около 200 мг фосфора.
Наиболее богаты фосфором
рыба - 180 мг в 100 г продукта,
фасоль - 540 мг на 100 г продукта,
сыр - до 600 мг на 100 г продукта.
яичный желток.
Слайд 12Аллотропные модификации
Белый фосфор (Х.Бранд – 1669 г.)
Коричневый фосфор (1669 г.)
Красный фосфор
Фиолетовый фосфор (А. А. Мусин-Пушкин 1797 г.)
Чёрный фосфор (П. Бриджмен , 1934 г.)
То красный он, то белый,
То черным станет вдруг,
То ядовитый, вредный,
А то наш лучший друг.
Слайд 13 Работа в группе
Аллотропные модификации.
Что такое аллотропия?
Способность атомов одного элемента образовывать несколько
Атомная кристаллическая решётка. Похож на графит. Чёрное, жирное на ощупь Тяжелее красного и белого фосфора. Проводит электрический ток. Нерастворим в воде и сероуглероде. Не светится, не ядовит.
Красный фосфор
Аморфное вещество . Цвет темно-красный, б запаха, нерастворим в воде и сероуглероде, атомная кристаллическая решётка. Не светится. Не ядовит!
Белый фосфор.
Ядовит! Кристаллическое вещество, белого цвета, с чесночным запахом. Молекулярная кристаллическая решётка. Светится в темноте. Легко самовоспламеняется, поэтому хранят в воде в стеклянной посуде, помещённой в металлическую банку с песком.
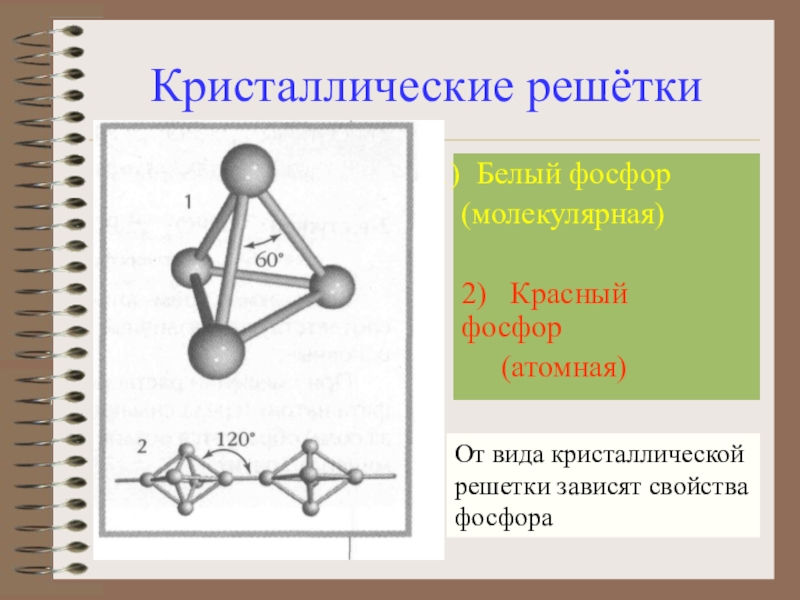
Слайд 14Кристаллические решётки
Белый фосфор
(молекулярная)
2) Красный фосфор
(атомная)
От вида кристаллической
Слайд 16Свеча, загорающаяся сама
Делается это так: на фитиль наносят раствор фосфора в
Слайд 19 2.Взаимодействие с металлами. При нагревании фосфора с
Слайд 21 Работа в группах
Применение
фосфора.
Круговорот
Растения Животные
Почва
Фосфоросодержащие
минералы и породы
Биологическое значение.
Ткани организмов. Кровь. Молоко.
Белки P АТФ.
.
« Элемент жизни и мысли»
ДНК . РНК.
Слайд 22Спички
Первые спички были созданы в 1827 г.
Они имели головку из
белого
Такие спички загорались при трении о любую поверхность, что нередко приводило к пожарам.
Ядовитость головок, состоящих из белого фосфора при неосторожном обращении приводила к отравлениям.
Слайд 23Шведские спички
Промышленное производство безопасных спичек началось в Швеции в 60-х гг.
Их до сих пор иногда называют шведскими спичками.
Они верно служат нам и по сей день.
Красный фосфор реагирует с бертолетовой солью. Эта реакция нашла применение при производстве спичек.
Слайд 24Холодное «химическое» свечение
Свечение паров белого фосфора послужило открытию химических реакций, которые
Слайд 25Заколдованные алмазы
На фоне черного бархата в запаянной стеклянной трубке покоились два
«Да ведь это алмазы!» — воскликнул пораженный студент, протягивая руку к футляру.
«Нет, нет! — решительно заявил профессор, закрывая и убирая футляр в портфель. — Не забывайте, что «холодный огонь» теряет силу от человеческих взоров!»
Слайд 26Через час жулики были в номере гостиницы и любовались добычей.
А кажется
не такой чистой воды, как показались
нам в начале?
«Это тебе просто мерещится», — ответил чернобородый, отбил верхнюю часть трубки, высыпал из нее кристаллы на ладонь, но, услышав стук в дверь, быстро опустил их в карман.
«Прошу извинить меня, — начал вошедший. — Что с вами?» — оборвал он свою речь, глядя с удивлением на чернобородого.
Чернобородый джентльмен сидел с выпученными глазами к как будто к чему-то прислушивался, потом вскочил, быстро сунул руку в карман, но тотчас выхватил ее обратно, точно обжегся.
Слайд 27Чернобородый с проклятиями заметался по комнате, потом схватил пятерней карман, отчаянным
«Старикашка, видимо, заколдовал их!» — с ужасом завопил он во весь голос. — Они превратились в раскаленные угли!»
Из кармана, в который он опустил кристаллы, вдруг повалил густой белый дым.
Слайд 28Вечером того же дня в городскую больницу был доставлен неизвестный с
«Старикашка определенно заколдовал свои алмазы! Они чуть не сожгли меня!» — завопил в ответ чернобородый.
Слайд 29Через два дня профессор, сильно расстроенный похищением трубки с кристаллами, читал
«Дурачье! Они в самом деле приняли их за алмазы! Если бы они знали химию, они, конечно, не допустили бы этой глупости!»
Что же представляли собой в действительности эти «алмазы»?
Слайд 30
А вот собака мчится.
О, ужас! Не смотри!
Во тьме она светится,
В
Но, кто же ты? Ответь нам.
И где тебя найти?
Стою в ряду я третьем,
Ты там меня ищи.
Слайд 31
Параграф 28 . упр. № 2,3 стр.163
Презентация «Спички»
Презентация «Содержание фосфора в костной ткани»