- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролиз 11 класс.
Содержание
- 1. Презентация по химии на тему Электролиз 11 класс.
- 2. Электролиз – это окислительно – восстановительный процесс,
- 3. Электролиты – вещества, растворы или расплавы которых
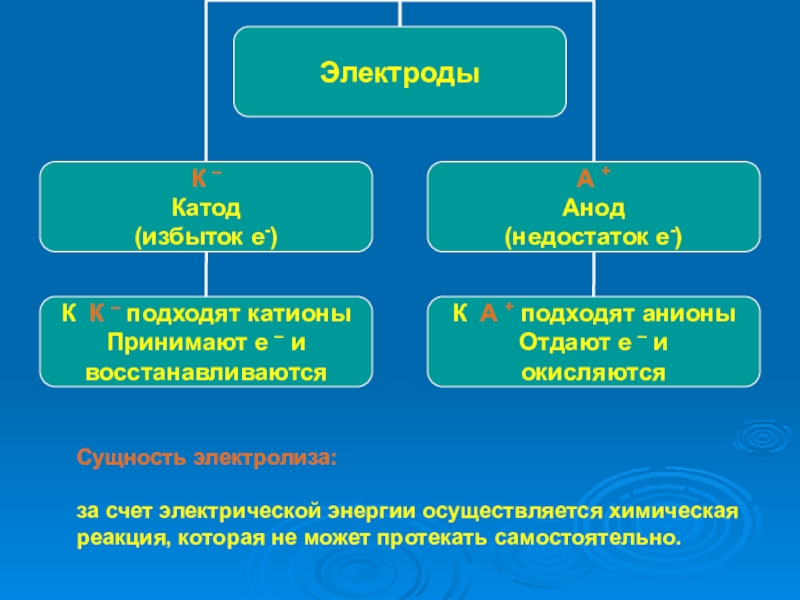
- 4. Сущность электролиза: за счет электрической
- 5. Электролиз расплавов
- 6. Электролиз растворов Кроме ионов вещества присутствуют молекулы
- 7. Катодные процессы в водном растворе К –
- 8. Анодные процессы в водных растворах. А +
- 9. Применение электролиза Основная химическая промышленностьполучение галогенов и
- 10. Химику надо знать, как протекает процесс
Электролиз – это окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Слайд 2Электролиз –
это окислительно – восстановительный процесс, протекающий на электродах при
прохождении электрического тока через расплав или раствор электролита.
Слайд 3Электролиты – вещества, растворы или расплавы которых проводят электрический ток.
Эти вещества
имеют ионную связь или сильно ковалентно – полярную.
щёлочи (Ме ОН)
кислоты (Н Ко)
соли (Ме Ко)
щёлочи (Ме ОН)
кислоты (Н Ко)
соли (Ме Ко)
Слайд 4Сущность электролиза: за счет электрической энергии осуществляется химическая реакция, которая не
может протекать самостоятельно.
Слайд 5Электролиз расплавов
К – Ме+ или (Н+) + е – - восстанавливаются
А + Ко – или (ОН-) – е – - окисляются
Пример: NaCl – расплав NaCl Na+ + Cl-
К – Na+ + 1e- = Nao 1e- 2
A + 2 Cl- – 2e- = Cl2o 2e- 1
2 Na+ + 2 Cl- = 2 Nao + Cl2о
электролиз
2 NaCl 2 Nao + Cl2о
расплав
А + Ко – или (ОН-) – е – - окисляются
Пример: NaCl – расплав NaCl Na+ + Cl-
К – Na+ + 1e- = Nao 1e- 2
A + 2 Cl- – 2e- = Cl2o 2e- 1
2 Na+ + 2 Cl- = 2 Nao + Cl2о
электролиз
2 NaCl 2 Nao + Cl2о
расплав
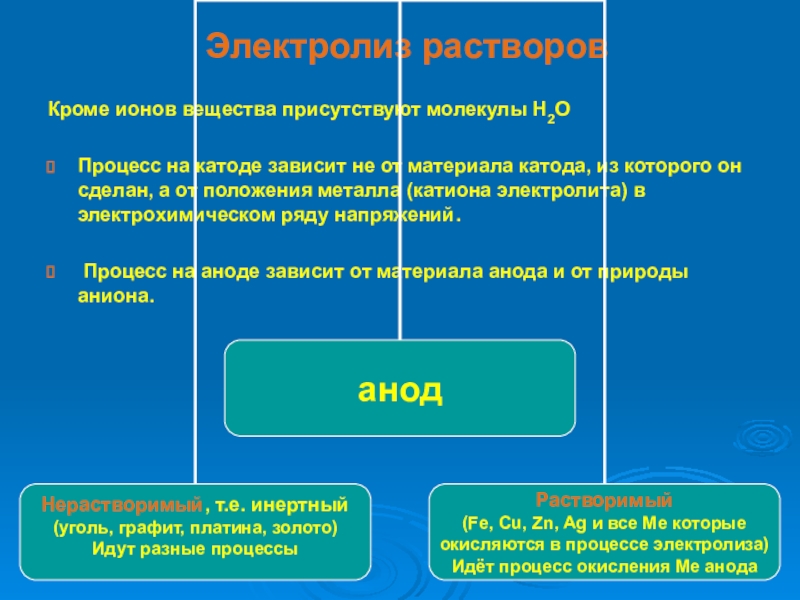
Слайд 6Электролиз растворов
Кроме ионов вещества присутствуют молекулы Н2О
Процесс на катоде зависит
не от материала катода, из которого он сделан, а от положения металла (катиона электролита) в электрохимическом ряду напряжений.
Процесс на аноде зависит от материала анода и от природы аниона.
Процесс на аноде зависит от материала анода и от природы аниона.
Слайд 7Катодные процессы в водном растворе
К –
усиливаются процессы восстановления (
+ е- )
Li+ K+ Ca2+ Na+ Mg2+ Al3+ Mn2+ Zn2+……Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+ Pt2+ Au2+
Ме+- не восстанавливаются Меn+ + n e- = Meo 2H+ Men+ + n e- = Meo
2 H2O + 2e- = H2 + 2 OH- и + 2e-
( 2H+ + 2e- = H2 ) 2 H2O + 2e- = H2 + 2 OH- = H2
Li+ K+ Ca2+ Na+ Mg2+ Al3+ Mn2+ Zn2+……Sn2+ Pb2+ H+ Cu2+ Hg2+ Ag+ Pt2+ Au2+
Ме+- не восстанавливаются Меn+ + n e- = Meo 2H+ Men+ + n e- = Meo
2 H2O + 2e- = H2 + 2 OH- и + 2e-
( 2H+ + 2e- = H2 ) 2 H2O + 2e- = H2 + 2 OH- = H2
Слайд 8Анодные процессы в водных растворах.
А +
I- Br-
S2- Cl- OH- SO42- CO32- NO3- F-
Нерастворимый окисление аниона 4ОН- - 4е- 2 Н2О - 4 е- = О2 + 4 Н+
анод ( Коn- ) = 2 Н2О + ( анионы Коn- остаются
Kon- - ne- = Koo + O2 в растворе )
Растворимый Происходит окисление металла анода
анод Мео – n e- = Men+
анод р-р
Нерастворимый окисление аниона 4ОН- - 4е- 2 Н2О - 4 е- = О2 + 4 Н+
анод ( Коn- ) = 2 Н2О + ( анионы Коn- остаются
Kon- - ne- = Koo + O2 в растворе )
Растворимый Происходит окисление металла анода
анод Мео – n e- = Men+
анод р-р
Слайд 9Применение электролиза
Основная химическая промышленность
получение галогенов и водорода
получение щелочей
электросинтез органических веществ
Металлургия
получение щелочных и щелочноземельных металлов ( из расплавов )
получение малоактивных металлов ( из растворов )
рафинирование ( очистка ) металлов
Металлообрабатывающая промышленность
гальваностегия - нанесение защитных антикоррозийных покрытий
электрохимическое полирование, сверление
Другие отрасли
гальванопластика – получение металлических копий, пластинок
Слайд 10
Химику надо знать, как протекает процесс электролиза, ему необходимо уметь
рассчитывать выход продуктов реакции. Для этого используется закон Фарадея:
M I t
m = F n
m - Масса выделившегося при электролизе на электроде вещества (г)
M - Молярная масса вещества (г/моль)
n - Количество отдаваемых или принимаемых электронов
I - Сила тока (А)
t - Продолжительность процесса (с)
F - Постоянная Фарадея (96 500 Кл/моль)
M I t
m = F n
m - Масса выделившегося при электролизе на электроде вещества (г)
M - Молярная масса вещества (г/моль)
n - Количество отдаваемых или принимаемых электронов
I - Сила тока (А)
t - Продолжительность процесса (с)
F - Постоянная Фарадея (96 500 Кл/моль)