- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ (9 класс)
Содержание
- 1. Презентация по химии на тему ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ (9 класс)
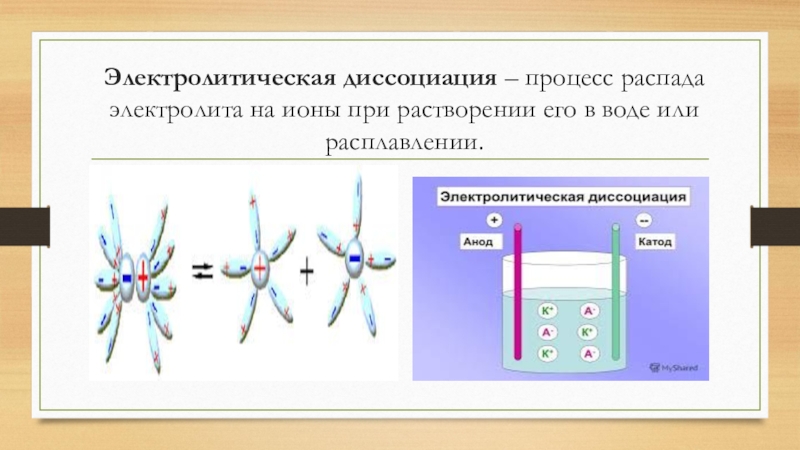
- 2. Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении.
- 3. ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ При растворении в
- 4. ВЕЩЕСТВА Электролиты – вещества, водные растворы или
- 5. Аррениус Сванте Август (19 февраля 1859
- 6. Диссоциация на ионы в растворах происходит вследствие
- 7. Основания - электролиты, при диссоциации которых в
- 8. Соли - называются электролиты, при диссоциации которых
- 9. Слайд 9
- 10. Кислоты - электролиты, при диссоциации которых в
- 11. Исходя из степени диссоциации все электролиты делятся
- 12. ДИССОЦИАЦИЯСлабые и сильные электролиты
Слайд 2Электролитическая диссоциация – процесс распада электролита на ионы при растворении его
Слайд 3ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
При растворении в воде электролиты диссоциируют на
Под действием электрического тока ионы приобретают направленное движение: катионы движутся к катоду, анионы – к аноду. (анод и катод – электроды).
Диссоциация – обратимый процесс: параллельно процессу распада электролита на ионы протекает процесс соединения ионов в молекулы – ассоциация.
Слайд 4ВЕЩЕСТВА
Электролиты – вещества, водные растворы или расплавы которых проводят электрический
Неэлектролиты - вещества, водные растворы или расплавы которых не проводят электрический ток, т.к. не диссоциируют на ионы. (Относят простые вещества, оксиды, большинство органических соединений. Вещества с неполярной или малополярной химической связью).
Слайд 5Аррениус Сванте Август (19 февраля 1859 г. – 2 октября 1927
Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году.
Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Слайд 6
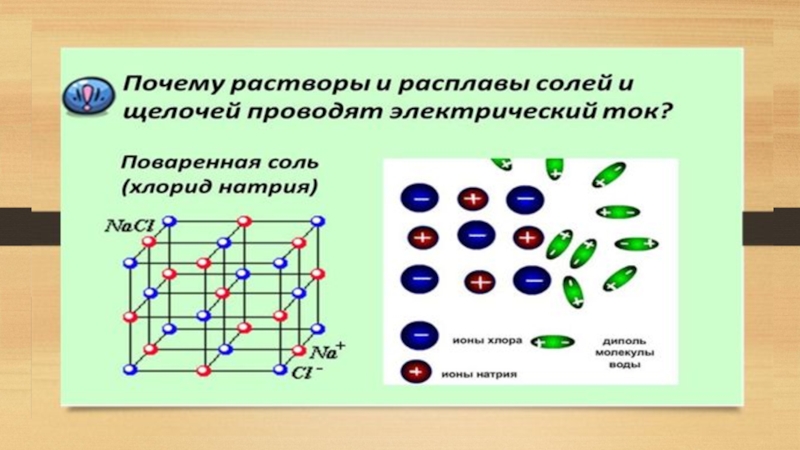
Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с
Под действием высоких температур ионы кристаллической решётки начинают совершать колебания, кинетическая энергия повышается, и наступит такой момент (при температуре плавления вещества), когда она превысит энергию взаимодействия ионов. Результатом этого является распад вещества на ионы.
Слайд 7
Основания - электролиты, при диссоциации которых в качестве анионов образуются только
KOH → K+ + OH –
Ba(OH)2 → Ba2+ +2OH –
Основания, растворимые в воде называются щелочами. Их немного. Это основания щелочных и щелочноземельных металлов: LiOH, NaОН, КОН, RbОН, СsОН, FrОН и Са(ОН)2, Sr(ОН)2, Ва(ОН)2, Rа(ОН)2, а также NН4ОН. Большинство оснований в воде малорастворимо.
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NН4ОН - однокислотное основание, Са(ОН)2 - двухкислотное, Fе(ОН)3 - трехкислотное и т.д. Двух- и многокислотные основания диссоциируют ступенчато
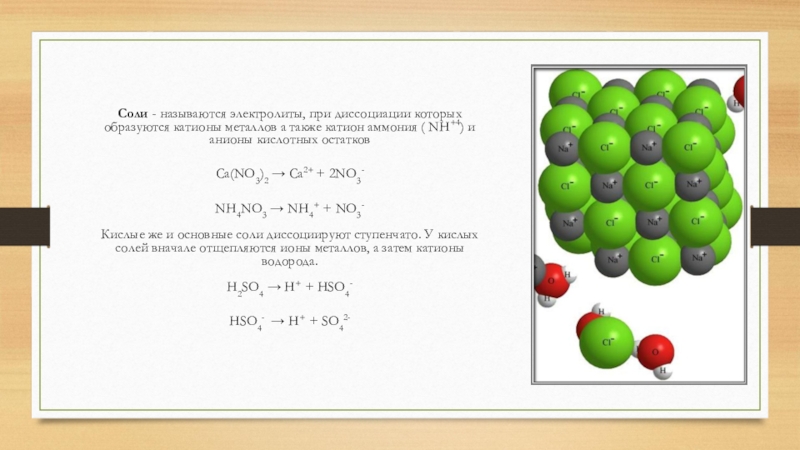
Слайд 8Соли - называются электролиты, при диссоциации которых образуются катионы металлов а
Ca(NO3)2 → Ca2+ + 2NO3-
NH4NO3 → NH4+ + NO3- Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. H2SO4 → H+ + HSO4-
HSO4- → H+ + SO42-
Слайд 10Кислоты - электролиты, при диссоциации которых в качестве катионов образуются только
Слайд 11
Исходя из степени диссоциации все электролиты делятся на две группы
Сильные электролиты
(сильные кислоты, такие как: HCIO4, HCIO3, HNO3, H2SO4, HCI, HBr, HI ).
2. Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (HCIO2, HCIO, HNO2, H2SO3, H2CO3, H2SiO3, H3PO4, H2S, CH3COOH , такие как HF), основания p-, d-, и f- элементов.
Между этими двумя группами чёткой границы нет,
одно и то же вещество может в одном растворителе проявлять свойства сильного электролита,
а в другом — слабого.