- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролитическая диссоциация
Содержание
- 1. Презентация по химии на тему Электролитическая диссоциация
- 2. Цели урока:1. Повторить химические свойства воды.2. Познакомиться
- 3. Вода! Викторина6CO2 + 6H2O → C6H12O6 +
- 4. Zn + H2O → ZnO + H2ВикторинаКакие
- 5. Викторина Какие из предложенныхвеществ будут вступать с водой в реакциисоединения?Оксиды металловМеталлы Кислоты Оксиды неметаллов
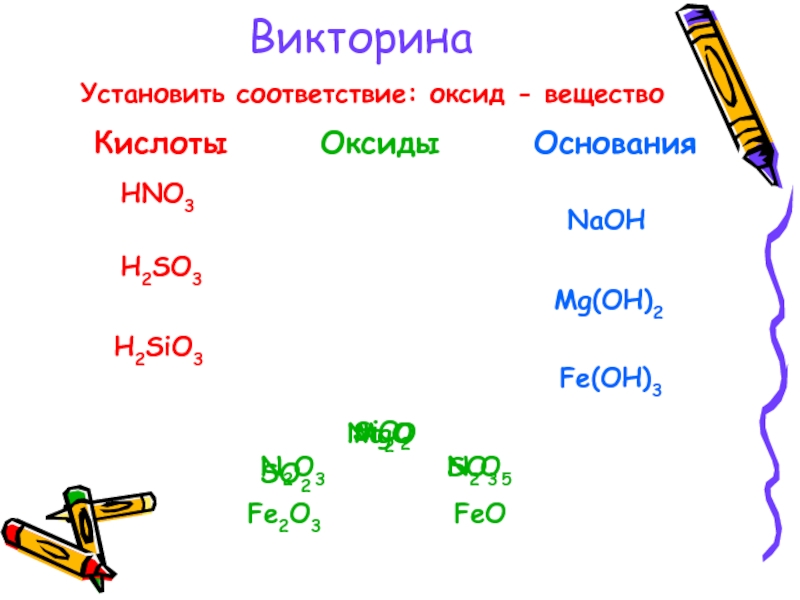
- 6. Викторина Установить соответствие: оксид - веществоSiO2Na2OMgON2O3N2O5SO2SO3FeOFe2O3
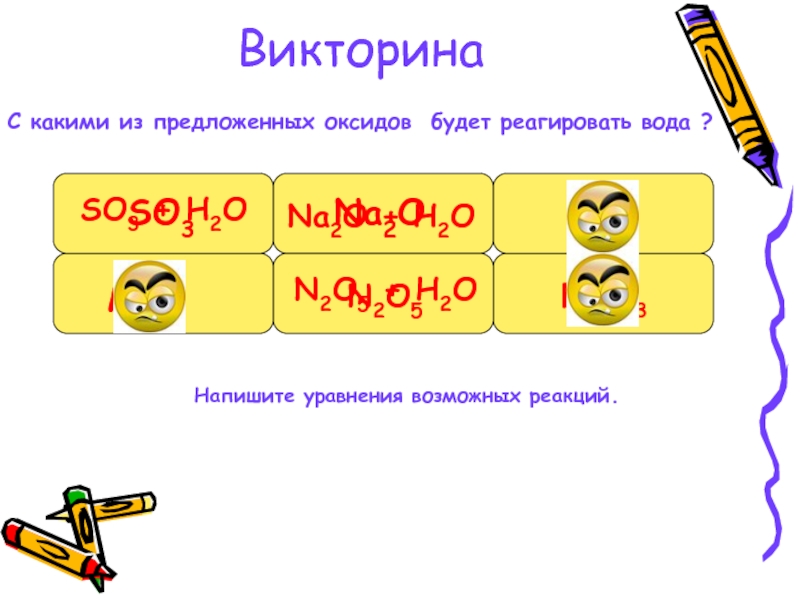
- 7. ВикторинаС какими из предложенных оксидов будет реагировать
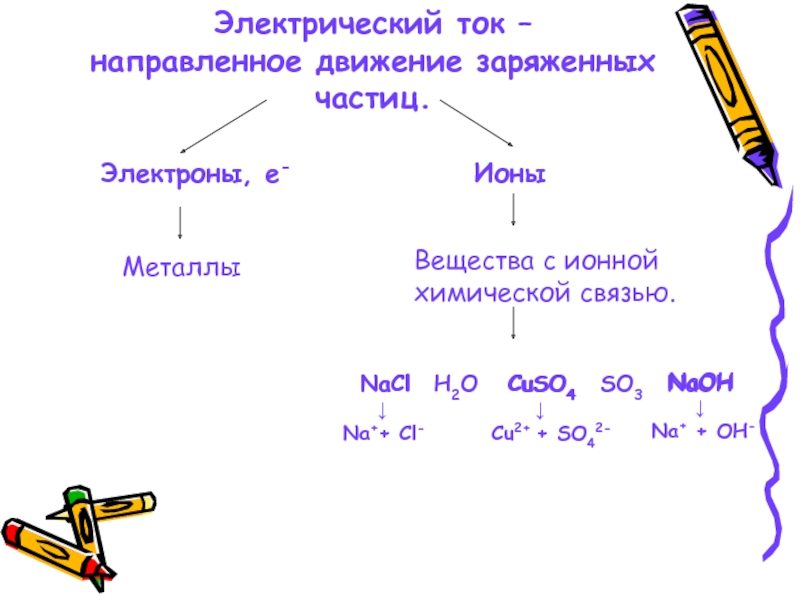
- 8. Электрический ток – направленное движение заряженных частиц.
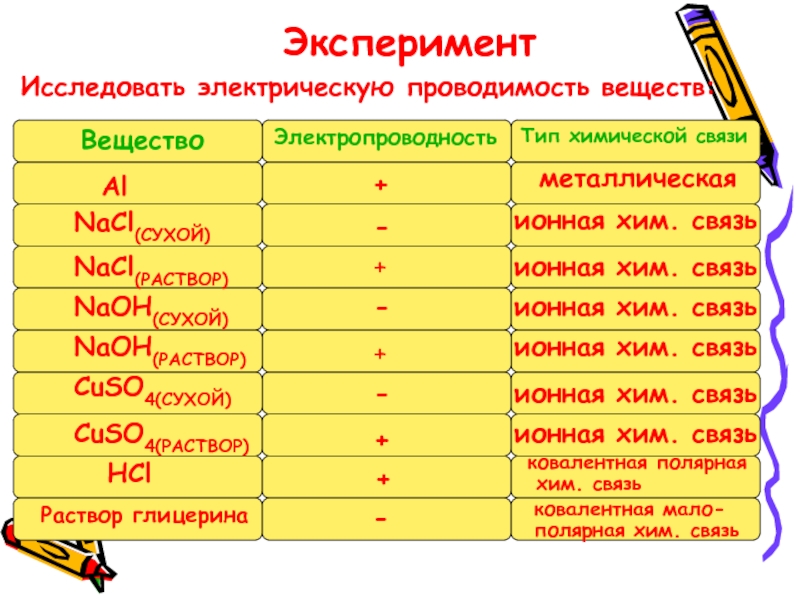
- 9. ЭкспериментИсследовать электрическую проводимость веществ:Вещество ЭлектропроводностьТип химической связиметаллическаяионная
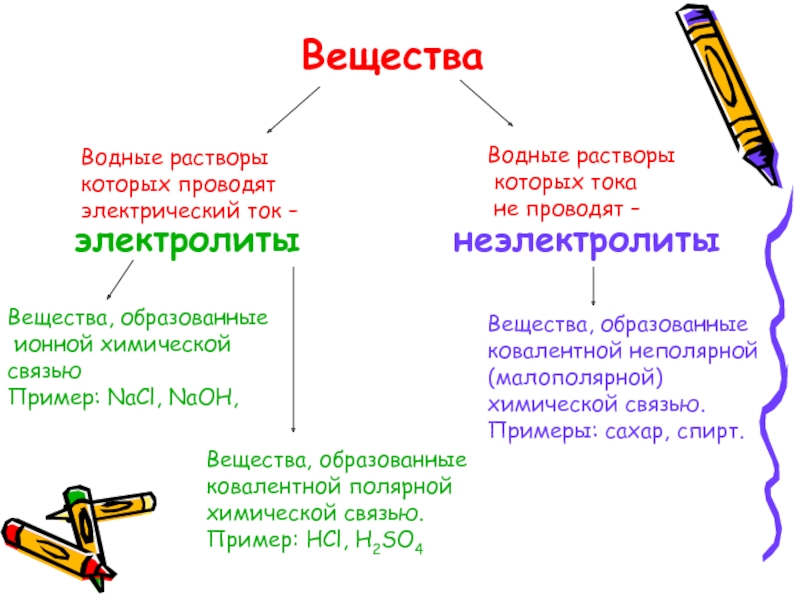
- 10. Водные растворыкоторых проводят электрический ток –Водные растворы которых тока не проводят –электролитынеэлектролиты
- 11. Почему же растворы электролитов проводят электрический ток
- 12. Строение молекулы воды: H2OМолекула воды образована ковалентной
- 13. Механизм электролитической диссоциации1. Ориентация молекул – диполей
- 14. Слайд 14
- 15. Роль процесса электролитической диссоциации
- 16. Роль процесса электролитической диссоциации для жизни человека.
- 17. Роль процесса электролитической диссоциации
- 18. Если вода темная, даже чернильная, с железистым
- 19. Домашнее задание §35 (перессказ) вопросы 1,2,4,5Спасибо за внимание
- 20. Список использованных источников:http://детсад2684.рф/prava.html http://www.domwoda.com/main.php?part=helphttp://www.eco-center.ru/sysfilter-ironwater.phphttp://www.vodakup.com.ua/articles.html?type=4http://apteka03.tomsk.ru/index.php?productID=28056
Слайд 1Еще одна тайна воды!
Урок по теме
«Электролитическая диссоциация»
8 класс
Муниципальное общеобразовательное учреждение
«Средняя
г. Алатыря.
Слайд 2Цели урока:
1. Повторить химические свойства воды.
2. Познакомиться с новыми понятиями:
неэлектролиты,
электролитическая диссоциация.
3. Рассмотреть механизм электролитической диссоциации.
4. Рассмотреть вопрос:
электролитическая диссоциация и жизнь человека,
Слайд 3Вода!
Викторина
6CO2 + 6H2O → C6H12O6 + 6O2
«Вода, у тебя
тебя не опишешь,
тобою наслаждаешься, не понимая, что ты такое!
Ты не просто необходима для жизни:
ты и есть жизнь».
Антуан де Сент-Экзюпери.
Слайд 4
Zn + H2O → ZnO + H2
Викторина
Какие из предложенных
веществ будут вступать
с водой в реакции
замещения?
Zn
S
Na
HCl
2Na+2H2O → 2NaOH + H2
Слайд 5Викторина
Какие из предложенных
веществ будут вступать
с водой в реакции
соединения?
Оксиды
металлов
Металлы
Кислоты
Оксиды
неметаллов
Слайд 7Викторина
С какими из предложенных оксидов будет реагировать вода ?
MgO
SO3
SO3 + H2O
Na2O
Na2O
SiO2
N2O5
N2O5 + H2O
Fe2O3
Напишите уравнения возможных реакций.
Слайд 8Электрический ток –
направленное движение заряженных частиц.
NaCl
NaCl
↓
Na++ Cl-
H2O
CuSO4
CuSO4
↓
Cu2+ + SO42-
SO3
NaOH
NaOH
↓
Na+ + OH-
Слайд 9Эксперимент
Исследовать электрическую проводимость веществ:
Вещество
Электропроводность
Тип химической связи
металлическая
ионная хим. связь
ионная хим. связь
ионная
ионная хим. связь
ионная хим. связь
ковалентная полярная
хим. связь
ионная хим. связь
ковалентная мало-
полярная хим. связь
Слайд 10Водные растворы
которых проводят
электрический ток –
Водные растворы
которых тока
не проводят
электролиты
неэлектролиты
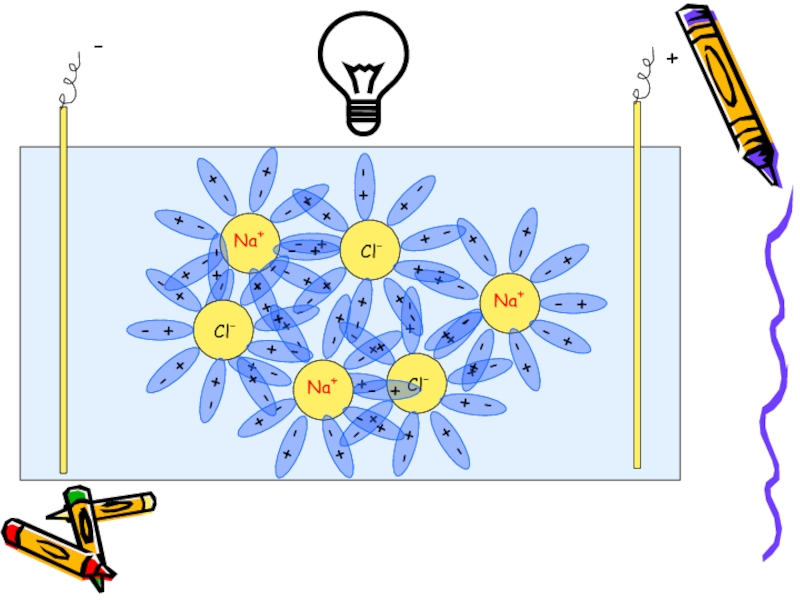
Слайд 11Почему же растворы электролитов проводят
электрический ток ?
Причина электропроводности – ионы,
электролита в воде.
Процесс распада электролита
на ионы называется
электролитической диссоциацией
Кистяковский
Владимир Александрович
Каблуков
Иван Алексеевич
При растворении электролита происходит химическое взаимодействие
растворенного вещества с водой, которое приводит к образованию
гидратов, а затем они диссоциируют на ионы.
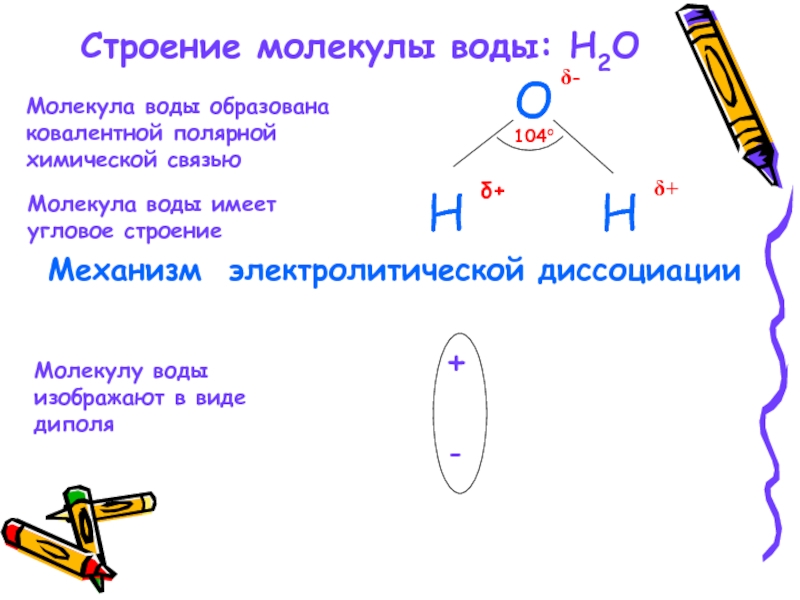
Слайд 12Строение молекулы воды: H2O
Молекула воды образована
ковалентной полярной
химической связью
Молекула воды
угловое строение
Молекулу воды
изображают в виде
диполя
Механизм электролитической диссоциации
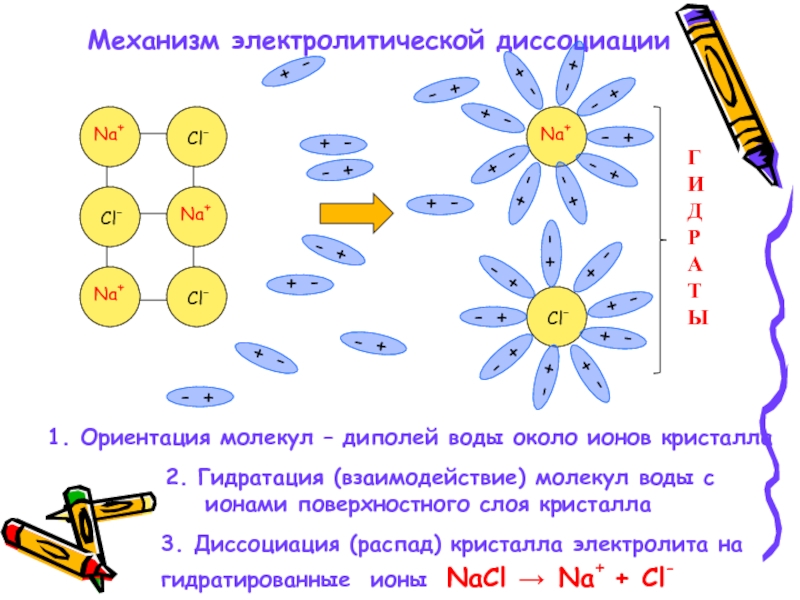
Слайд 13Механизм электролитической диссоциации
1. Ориентация молекул – диполей воды около ионов кристалла
ионами поверхностного слоя кристалла
3. Диссоциация (распад) кристалла электролита на
гидратированные ионы NaCl → Na+ + Cl-
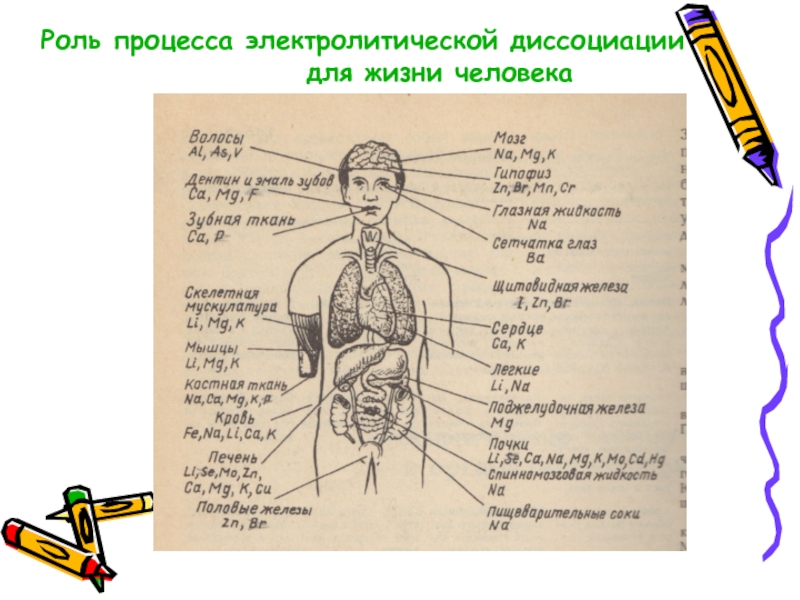
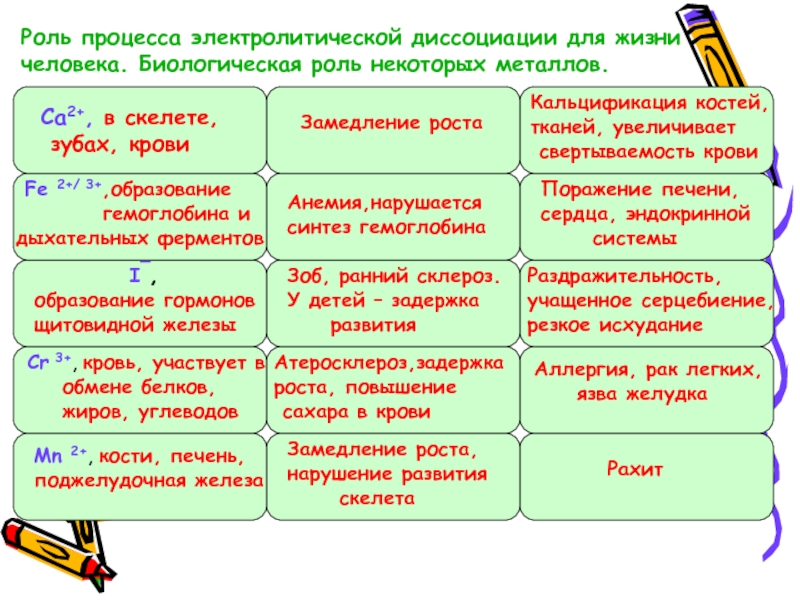
Слайд 16Роль процесса электролитической диссоциации для жизни человека. Биологическая роль некоторых металлов.
Ca2+,
зубах, крови
Замедление роста
Кальцификация костей,
тканей, увеличивает
свертываемость крови
Fe 2+/ 3+,образование
гемоглобина и
дыхательных ферментов
Анемия,нарушается
синтез гемоглобина
Поражение печени,
сердца, эндокринной
системы
Зоб, ранний склероз.
У детей – задержка
развития
Раздражительность,
учащенное серцебиение,
резкое исхудание
Атеросклероз,задержка
роста, повышение
сахара в крови
Аллергия, рак легких,
язва желудка
Замедление роста,
нарушение развития
скелета
Рахит
I¯,
образование гормонов
щитовидной железы
Cr 3+, кровь, участвует в
обмене белков,
жиров, углеводов
Mn 2+, кости, печень,
поджелудочная железа
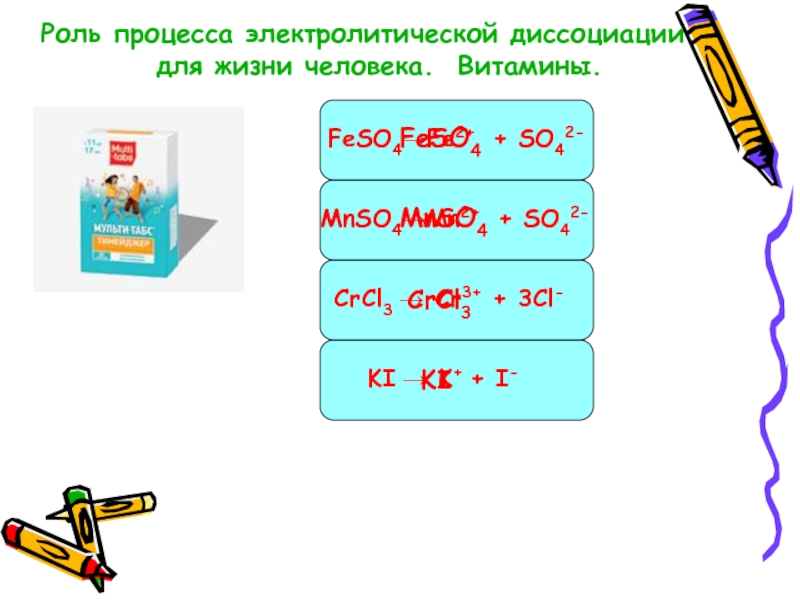
Слайд 17Роль процесса электролитической диссоциации
для жизни
FeSO4
MnSO4
CrCl3
KI
FeSO4→Fe2+ + SO42-
MnSO4→Mn2+ + SO42-
CrCl3 → Cr3+ + 3Cl-
KI → K+ + I-
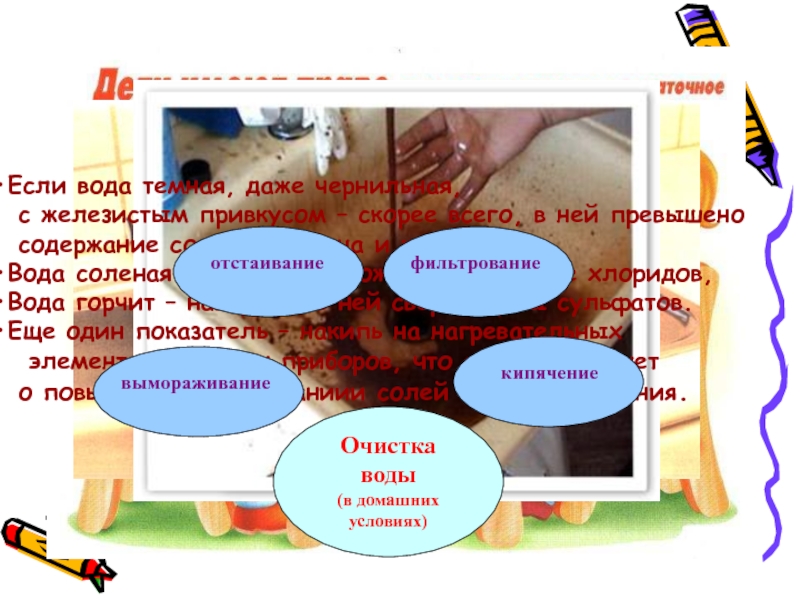
Слайд 18Если вода темная, даже чернильная,
с железистым привкусом – скорее всего,
содержание солей марганца и железа.
Вода соленая на вкус – возможно превышение хлоридов,
Вода горчит – наверняка в ней сверх нормы сульфатов.
Еще один показатель – накипь на нагревательных
элементах бытовых приборов, что свидетельствует
о повышенном содержаниии солей кальция и магния.