- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Диеновые УВ (10 класс)
Содержание
- 1. Презентация по химии на тему Диеновые УВ (10 класс)
- 2. Описывать особенности строения диеновых углеводородов.Применять принципы исторической,
- 3. 1.Диеновые углеводороды (алкадиены) - ациклические углеводороды, содержащие
- 4. 2.Классификация алкадиеновАлкадиены с кумулированными (примыкающими) связями:
- 5. 3.Номенклатура диеновых УВПравила:1. Главная цепь должна содержать
- 6. 3.Номенклатура диеновых УВ
- 7. ЕЖУ ПОНЯТНО ! Назовите этот углеводород:СН3 =
- 8. Гомологи - это вещества с одинаковыми химическими
- 9. 4.2Виды изомерии диеновых УВ1. Структурная: углеродного скелета;
- 10. 1.1 Изомерия углеродного скелета
- 11. 1.2 Изомерия положения двойных связей СН2=СН–СН=СН2Бутадиен-1,3С4Н6СН2=С=СН
- 12. 2.Межклассовая изомерия3. Межклассовая изомерия с алкинами и
- 13. Пространственная изомерия - диены, имеющие различные
- 14. 3.Пространственная изомерия диеновыхУВцис-изомергексадиена-2,4транс-изомергексадиена-2,4
- 15. 5.Строение молекулы бутадиена-1,3C4H6молекулярная формуладивинилСН2 = СН –
- 16. Электронное строение диенов.Кратность связей (число общих электронных
- 17. NB!!! СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.Присоединение галогенов, галогеноводородов, воды
- 18. 5.Химические свойства 1.Галогенирование
- 19. 5.Химические свойстваСН2=СН-СН=СН2 + Br2 → СН2 СН
- 20. 5.Химические свойства2.ГидрированиеСН2=СН−СН=СН2 → СН2−СН−СН−СН2 →СН3−СН=СН−СН3
- 21. 5.Химические свойства3. ГидрогалогенированиеСН2=СН-СН=СН2+HBr → CH3-CH=CH-CH2
- 22. +HCl+HClδ-δ+δ-δ+3. Гидрогалогенирование.4-хлорпентен-22,4-дихлорпентан+-+-электроноакцептор(по правилу Марковникова)
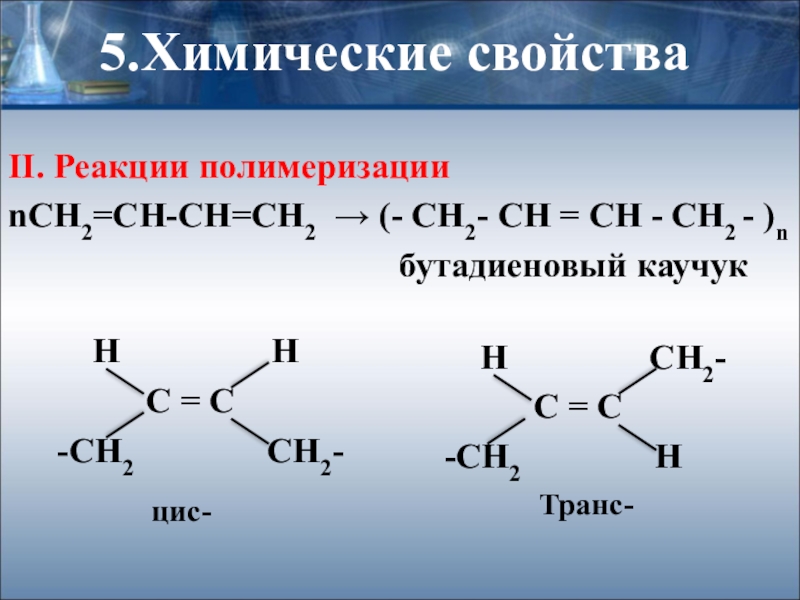
- 23. 5.Химические свойстваII. Реакции полимеризацииnСН2=СН-СН=СН2 → (- CH2-
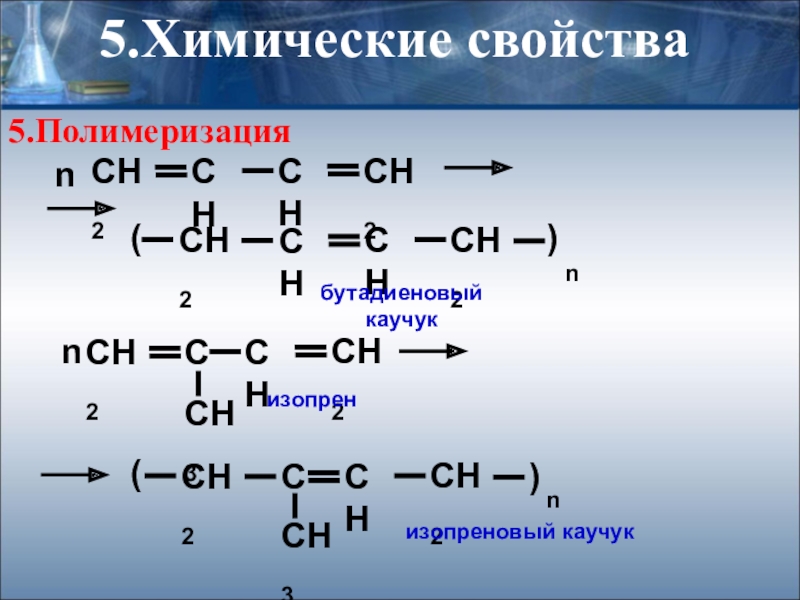
- 24. n()nn()nбутадиеновый каучукизопрен изопреновый каучук5.Полимеризация5.Химические свойства
- 25. 5.Химические свойства6.Горения 2С4 Н6 + 11О2 → 8СО2 + 6Н2О + Q
- 26. 7.Реакции окисления. Протекают так же, как и
- 27. 6.Способы полученияМетод Лебедева – из этанола при
- 28. 6.Способы получения2. Каталитическое дегидрирование алканов СН3−СН2−СН2−СН3 ⎯⎯⎯→
- 29. 6.Способы полученияДействие спиртового раствора щелочи на дигалогеналканы:
- 30. Слайд 30
- 31. 7.ПрименениеАлкадиены
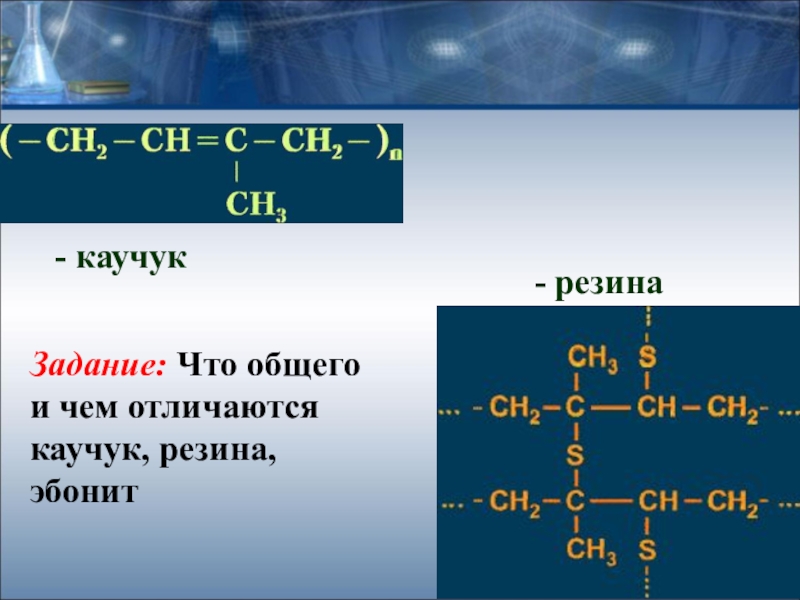
- 32. - каучук- резинаЗадание: Что общего и чем отличаются каучук, резина, эбонит
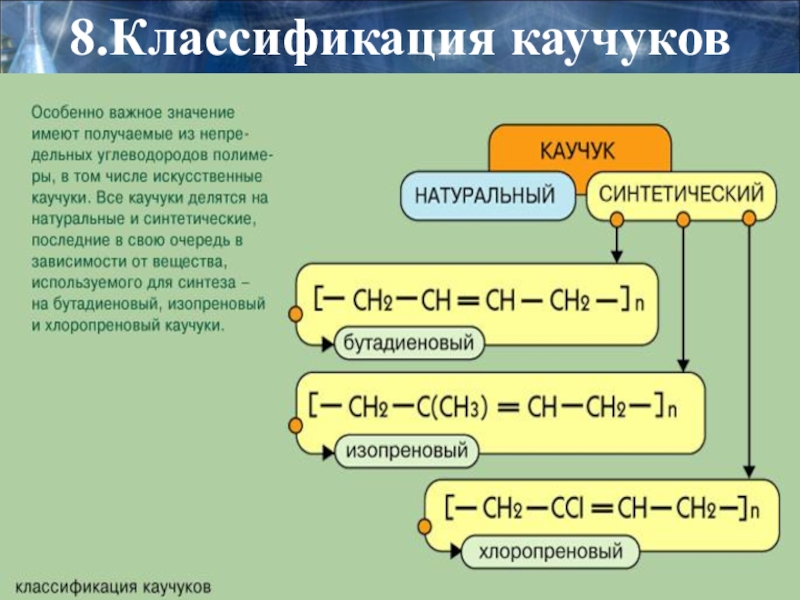
- 33. 8.Классификация каучуков
- 34. «Острова»о. ГрустиО. Удовольствияо.Тревогио.Просветленияо. Воодушевленияо.Неопределенностио. Недоуменияо.Радостио.Бермудскийтреугольник
- 35. Домашнее заданиеРазобрать и выучить конспект.Выучить параграф: §2.2.7Выполнить
Слайд 2Описывать особенности строения диеновых углеводородов.
Применять принципы исторической, систематической номенклатур, при составлении
Характеризовать химические свойства диеновых УВ с помощью уравнений реакций
Описывать способы получения, оценивать области применения диеновых УВ.
Осуществлять рефлексию учебной деятельности
В результате изучения темы, вы будете способны:
Слайд 31.Диеновые углеводороды (алкадиены)
- ациклические углеводороды, содержащие в молекуле две двойные
2 = связи – суффикс – диен
Общая формула:
СnH2n-2
Пропадиен (аллен)
C3H4 -
C4H6 -
Бутадиен-1,4
СН2 = С = СН2
СН2 = СН – СН = СН2
Слайд 42.Классификация алкадиенов
Алкадиены с кумулированными (примыкающими) связями:
Алкадиены с изолированными связями:
Алкадиены с сопряженными связями:
СН2 = С = СН – СН3
СН2 = СН – СН2 – СН = СН2
СН2 = СН – СН = СН2
Бутадиен-1,2
Пентадиен-1,4
Бутадиен-1,3
Слайд 53.Номенклатура диеновых УВ
Правила:
1. Главная цепь должна содержать обе двойные связи.
2. Нумерацию
3. Называют заместители и указывают атомы углерода от которого они отходят.
4. Указывают название алкадиена и атомы углерода от которых образована двойная связь.
Слайд 63.Номенклатура диеновых УВ
СН3-СН-СН2-С=СН-СН=СН2
Назовите вещество
4,6-диметилгептадиен-1,3
Слайд 7ЕЖУ ПОНЯТНО !
Назовите этот углеводород:
СН3 = СН – СН2 –
Напишите формулу по названию:
3-метилпентадиен–1,3
Слайд 8Гомологи - это вещества с одинаковыми химическими свойствами, но отличающиеся друг
4.Гомология и изомерия диеновых УВ
C4H6
бутадиен-1,3
C5H8
пентадиен-1,3
дивинил
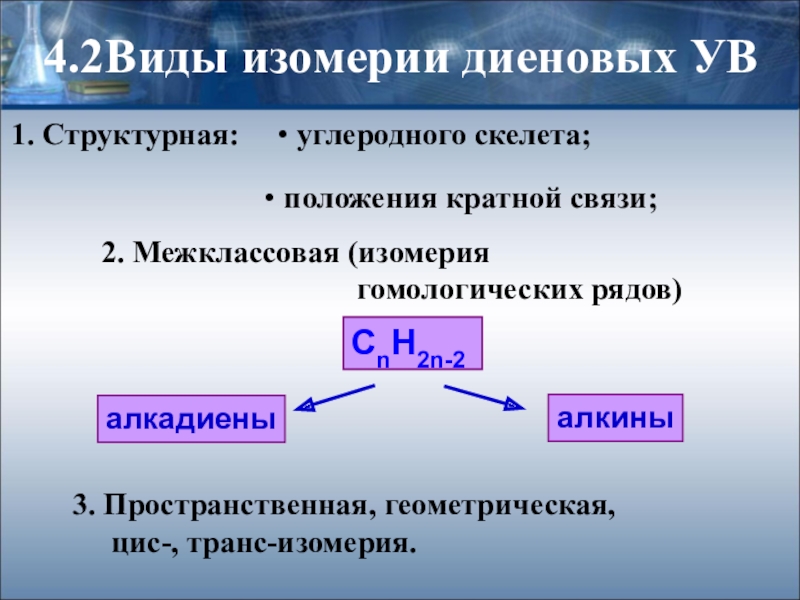
Слайд 94.2Виды изомерии диеновых УВ
1. Структурная:
углеродного скелета;
положения кратной связи;
2.
гомологических рядов)
CnH2n-2
алкадиены
алкины
3. Пространственная, геометрическая,
цис-, транс-изомерия.
Слайд 10
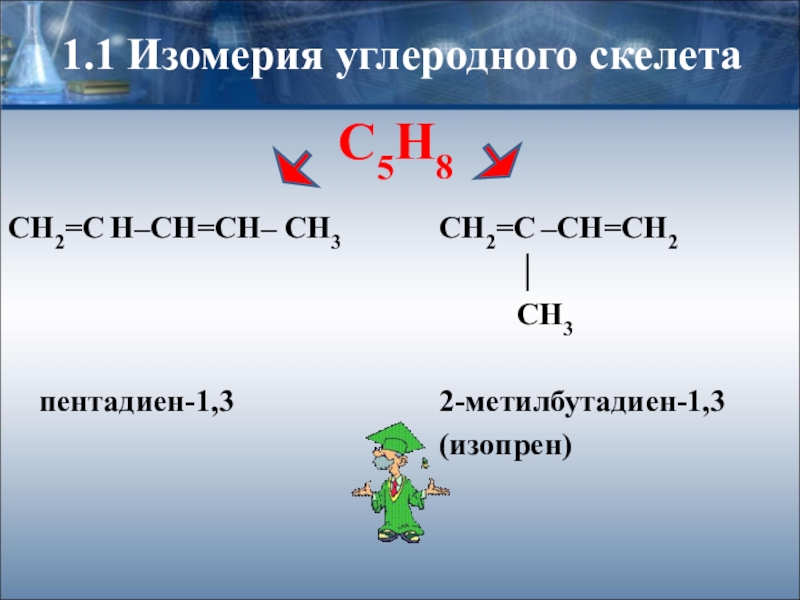
1.1 Изомерия углеродного скелета
СН2=С –СН=СН2
│
СН3
2-метилбутадиен-1,3
(изопрен)
СН2=С Н–СН=СН– СН3
пентадиен-1,3
С5Н8
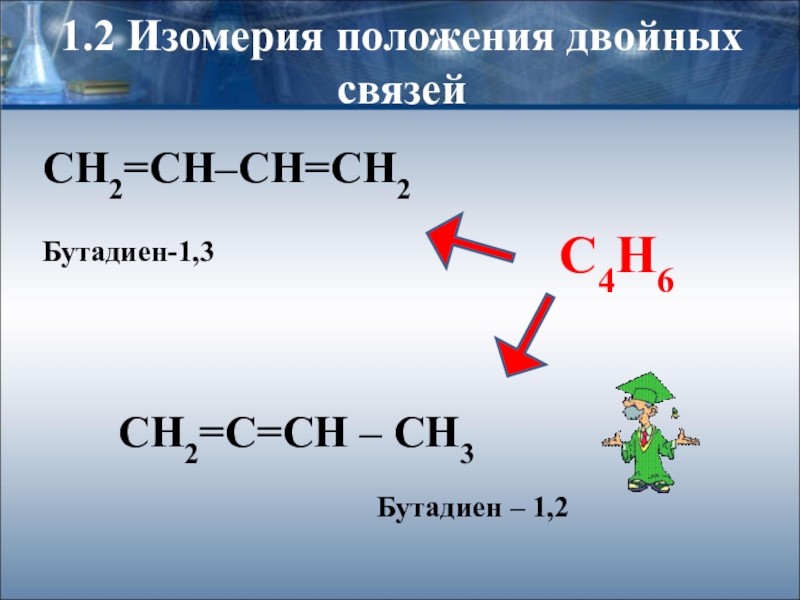
Слайд 111.2 Изомерия положения двойных связей
СН2=СН–СН=СН2
Бутадиен-1,3
С4Н6
СН2=С=СН – СН3
Слайд 122.Межклассовая изомерия
3. Межклассовая изомерия с алкинами и циклоалкенами. Например, формуле С4Н6
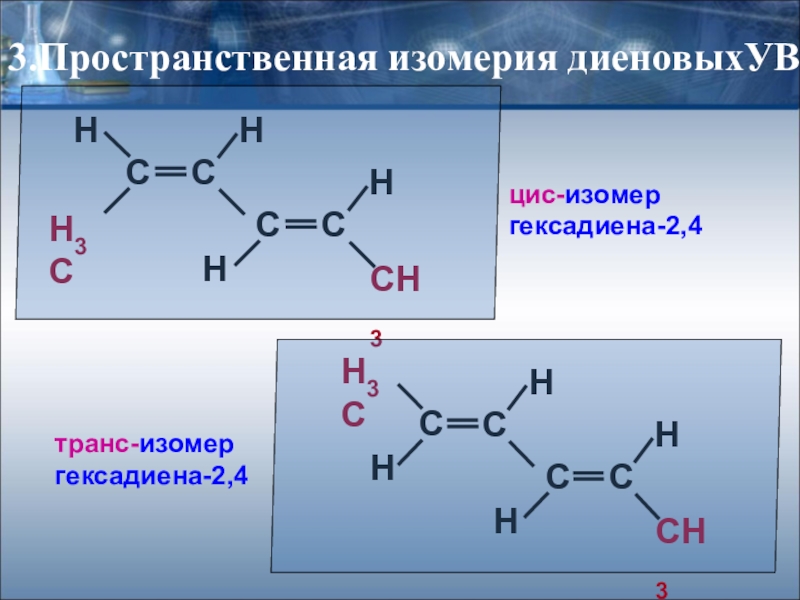
Слайд 13Пространственная изомерия -
диены, имеющие различные заместители при углеродных атомах
3.Пространственная изомерия диеновыхУВ
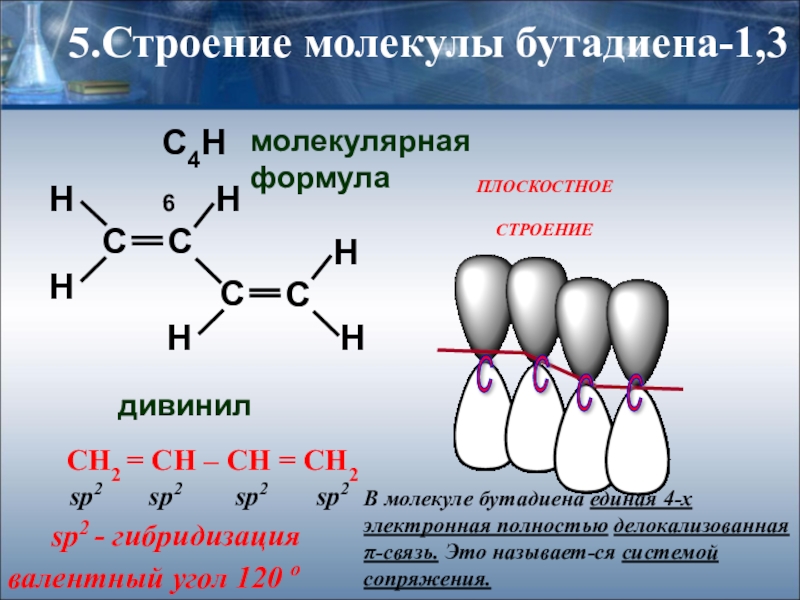
Слайд 155.Строение молекулы бутадиена-1,3
C4H6
молекулярная формула
дивинил
СН2 = СН – СН = СН2
sp2
sp2 - гибридизация
валентный угол 120 о
ПЛОСКОСТНОЕ
СТРОЕНИЕ
С
С
С
С
В молекуле бутадиена единая 4-х электронная полностью делокализованная π-связь. Это называет-ся системой сопряжения.
Слайд 16Электронное строение диенов.
Кратность связей (число общих электронных пар) между атомами углерода
CH2 – CH – CH – CH2
Слайд 17NB!!! СВОЙСТВА СОПРЯЖЕННЫХ АЛКАДИЕНОВ.
Присоединение галогенов, галогеноводородов, воды и других полярных реагентов
Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная системы из двух двойных связей.
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения).
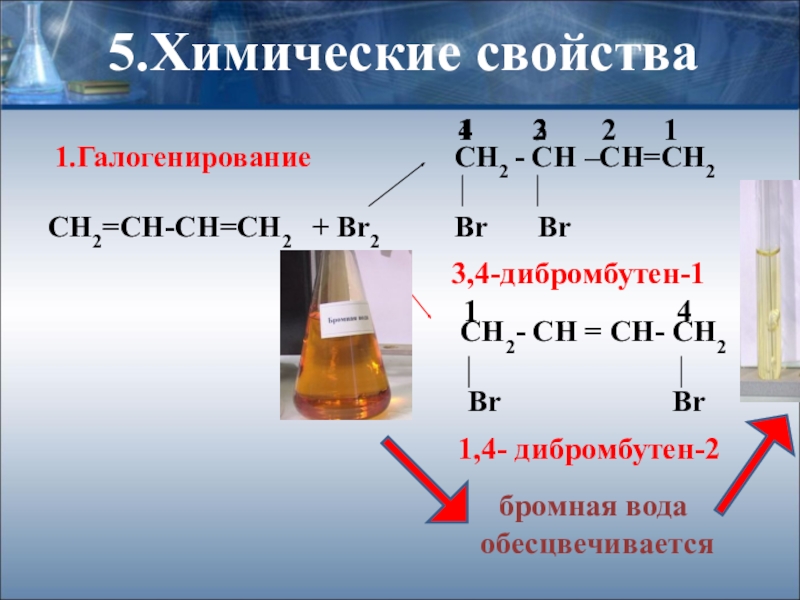
Слайд 185.Химические свойства
1.Галогенирование
СН2=СН-СН=СН2 + Br2 Br Br
CH2- CH = CH- CH2
Br Br
3,4-дибромбутен-1
1,4- дибромбутен-2
4
1
1
2
1
2
3
4
бромная вода
обесцвечивается
Слайд 195.Химические свойства
СН2=СН-СН=СН2 + Br2 → СН2 СН СН СН2 +
СН2=СН-СН=СН2 + 2Br2 → CH2- CH - CH- CH2
Br
Br
1
2
4
3
1,4- дибромбутен-2
Br
Br
Br
Br
1,2,3,4 - тетрабромбутан
При дальнейшем бромировании- напишите уравнение реакции и назовите вещество
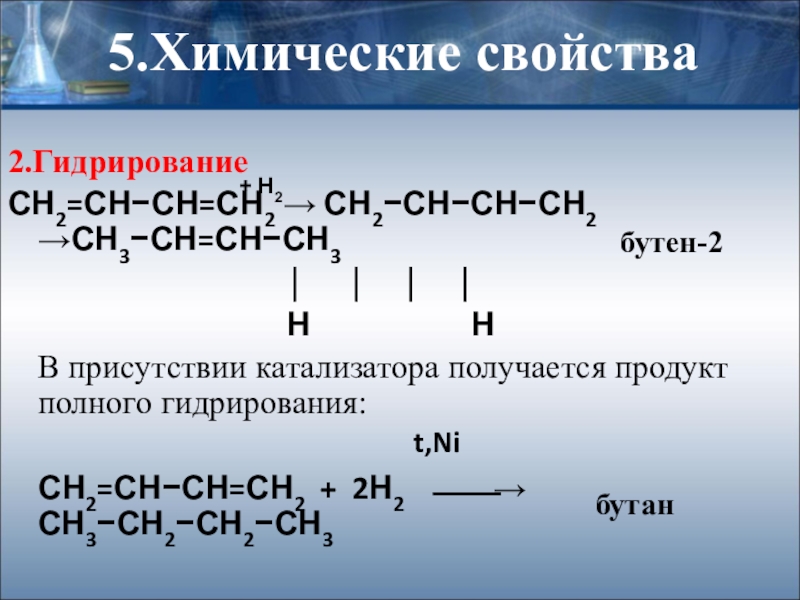
Слайд 205.Химические свойства
2.Гидрирование
СН2=СН−СН=СН2 → СН2−СН−СН−СН2 →СН3−СН=СН−СН3
Н Н
В присутствии катализатора получается продукт полного гидрирования:
СН2=СН−СН=СН2 + 2Н2 ⎯⎯→ СН3−СН2−СН2−СН3
бутен-2
бутан
t,Ni
+ H2
Слайд 215.Химические свойства
3. Гидрогалогенирование
СН2=СН-СН=СН2+HBr → CH3-CH=CH-CH2
Br
1-бромбутен-2
NB!! Если симметричная молекула
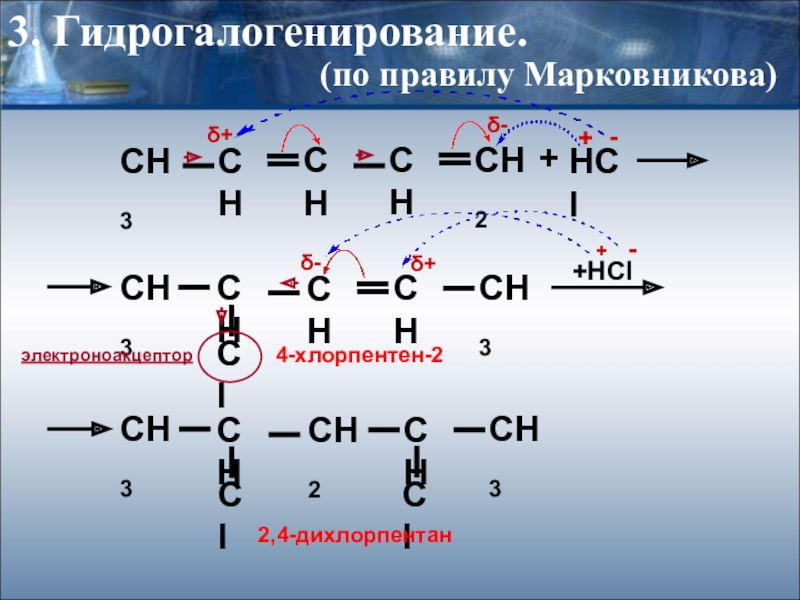
Слайд 22+
HCl
+HCl
δ-
δ+
δ-
δ+
3. Гидрогалогенирование.
4-хлорпентен-2
2,4-дихлорпентан
+
-
+
-
электроноакцептор
(по правилу Марковникова)
Слайд 235.Химические свойства
II. Реакции полимеризации
nСН2=СН-СН=СН2 → (- CH2- CH = CH -
бутадиеновый каучук
Н Н
С = С
-СН2 СН2-
Н СН2-
С = С
-СН2 Н
цис-
Транс-
Слайд 267.Реакции окисления.
Протекают так же, как и в случае алкенов –
СН2=СН –СН=СН2 + KMnO4 + H2O ?
СН2 – СН – СН – СН2 +MnO2 + KOH
│ │ │ │
OH OH OH OH
бутантетраол-1,2,3,4 (многоатомный спирт)
5.Химические свойства
Слайд 276.Способы получения
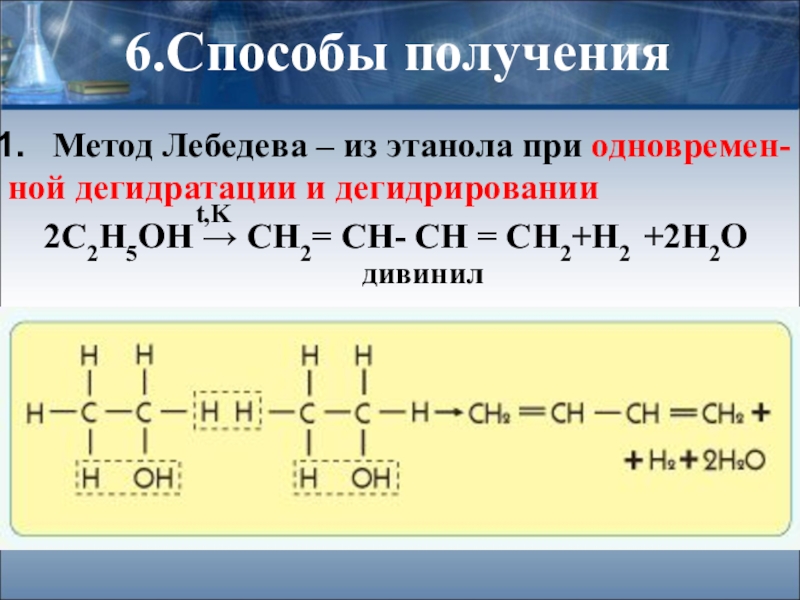
Метод Лебедева – из этанола при одновремен-
ной дегидратации и дегидрировании
t,K
дивинил
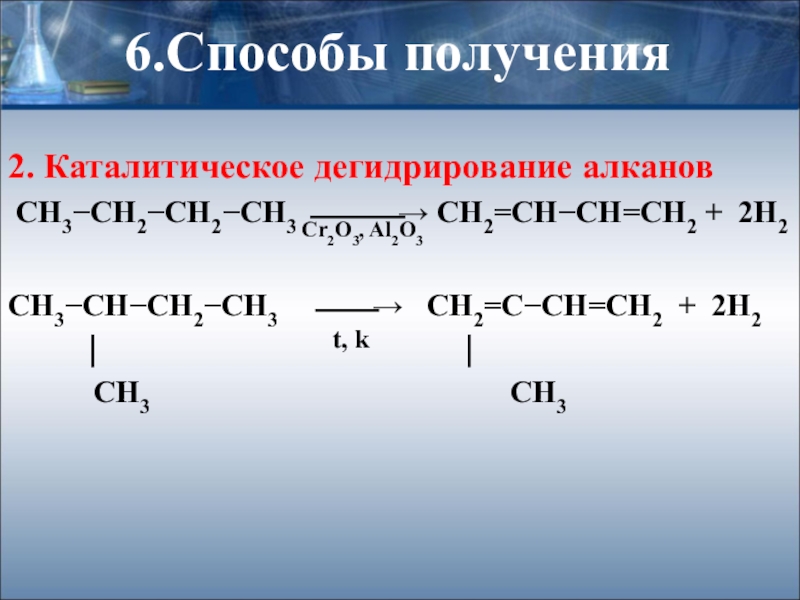
Слайд 286.Способы получения
2. Каталитическое дегидрирование алканов
СН3−СН2−СН2−СН3 ⎯⎯⎯→ СН2=СН−СН=СН2 + 2Н2
СН3−СН−СН2−СН3
⏐ ⏐
СН3 СН3
Cr2O3, Al2O3
t, k
Слайд 296.Способы получения
Действие спиртового раствора щелочи на дигалогеналканы:
СН2−СН−СН−СН2 +
СН2=СН−СН=СН2 + 2KCl + 2Н2О
Cl
Cl
Н
Н
KOH(спирт) ⎯⎯→
Бутадиен – 1,3