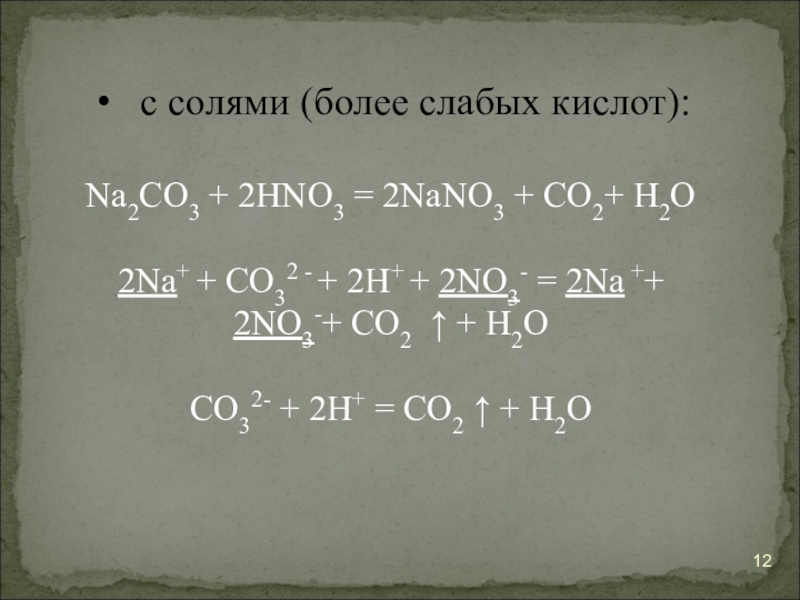- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Азотная и фосфорная кислоты
Содержание
- 1. Презентация по химии на тему Азотная и фосфорная кислоты
- 2. Азотная кислота
- 3. Впервые азотную кислоту получили алхимики, нагревая смесь
- 4. Опытным путем доказано, что двойная связь
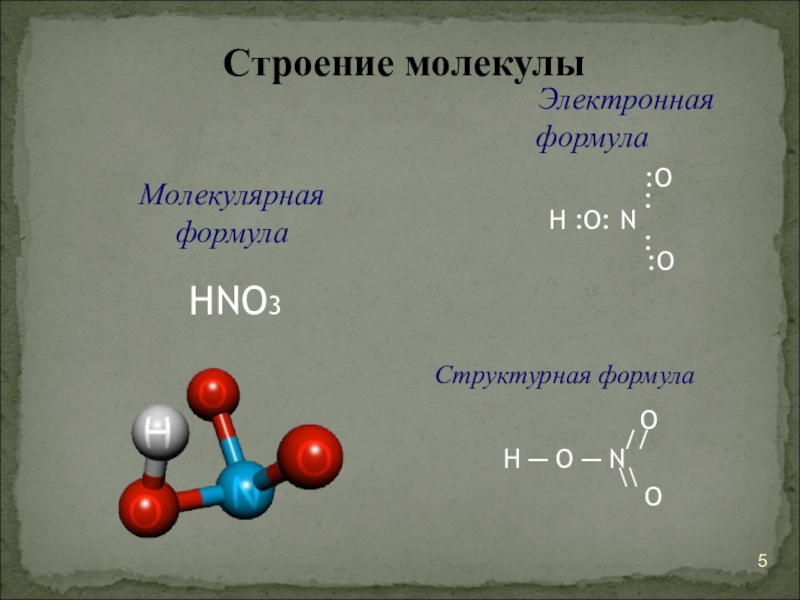
- 5. Строение молекулы
- 6. По основности:
- 7. Физические свойства
- 8. Химические свойства:общие с другими кислотами
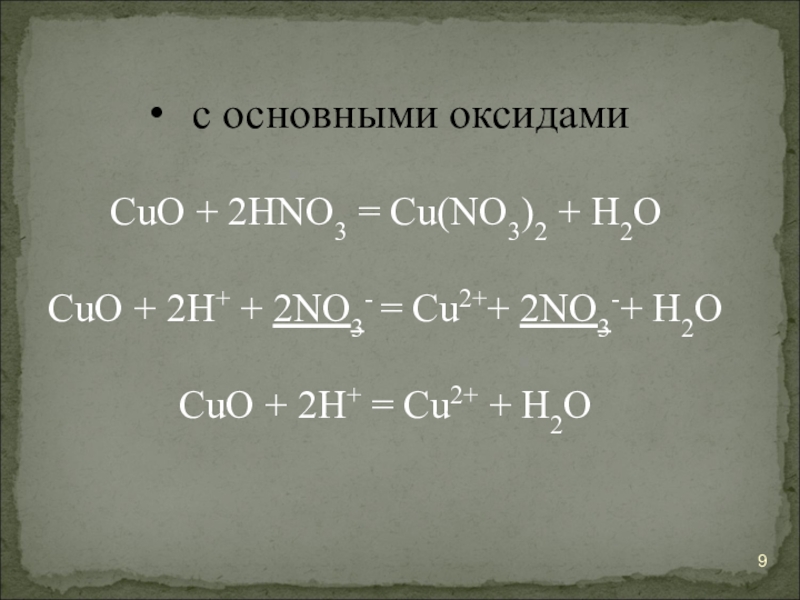
- 9. с основными оксидамиCuO + 2HNO3 = Cu(NO3)2 + H2OCuO
- 10. с нерастворимыми основаниями:Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2OCu(OH)2 + 2H++
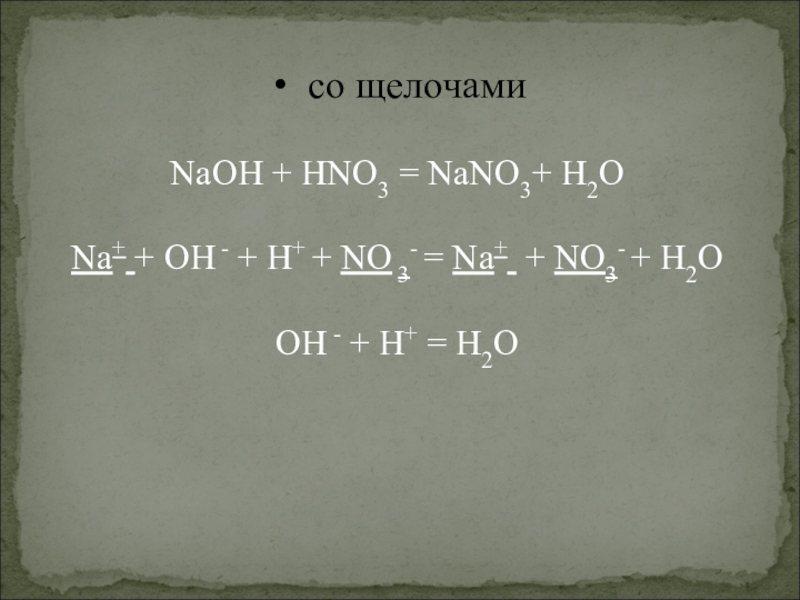
- 11. со щелочамиNaOH + HNO3 = NaNO3+ H2ONa+ + OH
- 12. с солями (более слабых кислот):Na2CO3 + 2HNO3 = 2NaNO3 +
- 13. специфические:
- 14. Взаимодействие с металлами:При взаимодействии с металлами Н2
- 15. 1. Схема последовательного
- 16. Применение Азотной кислоты: - производство азотных и
- 17. Фосфорная кислота
- 18. Состав молекулы
- 19. Н3РО4 Фосфорная кислота Н3РО4 = Н+ +
- 20. Ортофосфорная кислота Н3РО4
- 21. Ортофосфорная кислота Н3РО4 Является
- 22. Ортофосфорная кислота Н3РО43) Кислые-гидрофосфаты- СаНРО4 Которые малорастворимы
- 23. Ортофосфорная кислота Н3РО4
- 24. Слайд 24
- 25. Качественная реакция на фосфат-ион РО43- РО43-
- 26. Слайд 26
- 27. Слайд 27
Слайд 3Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
4KNO3
Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды
История получения
Слайд 4
Опытным путем доказано, что двойная связь равномерно распределена между
Кристаллическая решетка – молекулярная
Строение
Слайд 5Строение молекулы
Электронная формула
:O
:
H :O: N
:
:O
Структурная формула
O
//
H ─ O ─ N
\\
O
Молекулярная формула
HNO3
Слайд 6По основности:
По содержанию «О»:
кислородсодержащая
По растворимости в воде:
растворимая
По летучести:
летучая
По степени диссоциации:
сильная
Характеристика кислоты
Слайд 7Физические свойства
4HNO3 ---------->
свет
4NO2 ↑+ O2 ↑ + 2H2O
Конц. Азотная кислота обычно окрашена в жёлтый цвет
Tплав.= -41,60 С
Tкип. = 82,60 С
Бесцветная жидкость
Летучая(на воздухе «дымит»)
Неограниченно смешивается с водой
p = 1,52
Слайд 8Химические свойства:
общие с другими кислотами
НNO3 + лакмус =
НNO3 + метилоранж =
НNO3
H+ + NO3-
Слайд 9с основными оксидами
CuO + 2HNO3 = Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- =
CuO + 2H+ = Cu2+ + H2O
Слайд 10с нерастворимыми основаниями:
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2 + 2H++ 2NO 3- = Cu2+
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Слайд 11со щелочами
NaOH + HNO3 = NaNO3+ H2O
Na+ + OH - + H+ + NO
OH - + H+ = H2O
Слайд 12с солями (более слабых кислот):
Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O
2Na+ + CO32
CO32- + 2H+ = CO2 ↑ + H2O
Слайд 13специфические:
4HNO3 = 2H2O + 4NO2 + O2
Реагирует с неметаллами
С + 4HNO3(конц.) = CO2↑ + 4NO2↑ + 2H2O
S+6HNO3(60%) =H2SO4+6NO2↑+ 2H2O
S+2HNO3(40%) =H2SO4+2NO ↑
P+5HNO3(60%) =H3PO4+5NO2↑+ H2O
P+ 5HNO3(30%)+2H2O =3H3PO4+5NO ↑
NO неMe + HNO3 NO2
.
Азотная кислота окисляет неметаллы
Слайд 14Взаимодействие с металлами:
При взаимодействии с металлами
Н2 никогда не выделяется
Образуются: нитрат,
HNO3(р.)+Me(до H2)→нитрат+H2O+NH3(NH4NO3)
HNO3(р.)+Me(после H2)→нитрат+H2O+NO
HNO3(к.)+Me(до H2)→нитрат+H2O+N2O(N2)
HNO3(к.)+Me(после H2)→нитрат+H2O+NO2
Концентрированная HNO3 на Al, Cr, Fe, Au, Pt не действует.
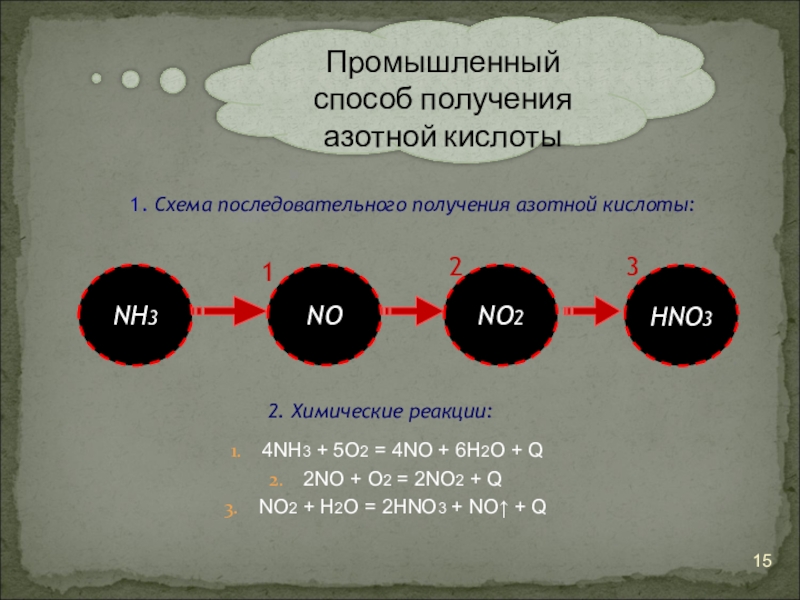
Слайд 15 1. Схема последовательного получения азотной кислоты:
Промышленный способ
2. Химические реакции:
1
2
3
4NH3 + 5О2 = 4NO + 6Н2О + Q
2NO + O2 = 2NO2 + Q
NO2 + H2O = 2HNO3 + NO↑ + Q
Слайд 16Применение Азотной кислоты:
- производство азотных и комбинированных удобрений,
-взрывчатых веществ
-органических красителей.
-как окислитель ракетного топлива.
- В металлургии Азотная кислота применяют для травления и растворения металлов, а также для разделения золота и серебра.
Слайд 18Состав молекулы
Н-О – Р О Н О Р О
Н-О Н О
структурная электронная
формула формула
Фосфорная кислота не является окислителем и не разлагается при нагревании, что объясняется наибольшей устойчивостью степени окисления +5 из всех возможных для фосфора.
Слайд 19Н3РО4
Фосфорная кислота
Н3РО4 = Н+ + Н2РО4-
Н2РО4- = Н+
НРО42- = Н+ + РО43-
ОН
ОН Р ОН
О
Структурная формула
Диссоциация кислоты
Слайд 20 Ортофосфорная кислота Н3РО4
Белые прозрачные кристаллы,
не ядовита
Кислота средней силы
С водой смешивается в любых соотношениях.
Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается.
Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)
Слайд 21
Ортофосфорная кислота Н3РО4
Является трехосновной кислотой и образует три ряда солей:
1) средние
Которые нерастворимы в воде, кроме фосфатов щелочных металлов
2) Кислые-дигидрофосфаты- Са(Н2РО4)2
Большинство из которых хорошо растворимы в воде
Слайд 22Ортофосфорная кислота Н3РО4
3) Кислые-гидрофосфаты- СаНРО4
Которые малорастворимы в воде (кроме фосфатов
Вывод: с увеличением содержания атомов водорода в молекуле соли, ее растворимость повышается.
Слайд 23 Ортофосфорная кислота Н3РО4
Н3РО4 проявляет все свойства кислот
Реагирует:
1) со щелочами: NaOH, КОН
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) с металлами не реагирует
Слайд 24
Химические свойства
Фосфаты
Щ и Ме при растворении в кислоте, начинают взаимодействовать с водой.
Некоторые реакции с металлами протекают в очень разбавленных растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑
Слайд 25Качественная реакция
на фосфат-ион РО43-
РО43- + 3 Ag+
Полученный осадок растворяется в сильных кислотах.
По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr
AgCl – белого цвета
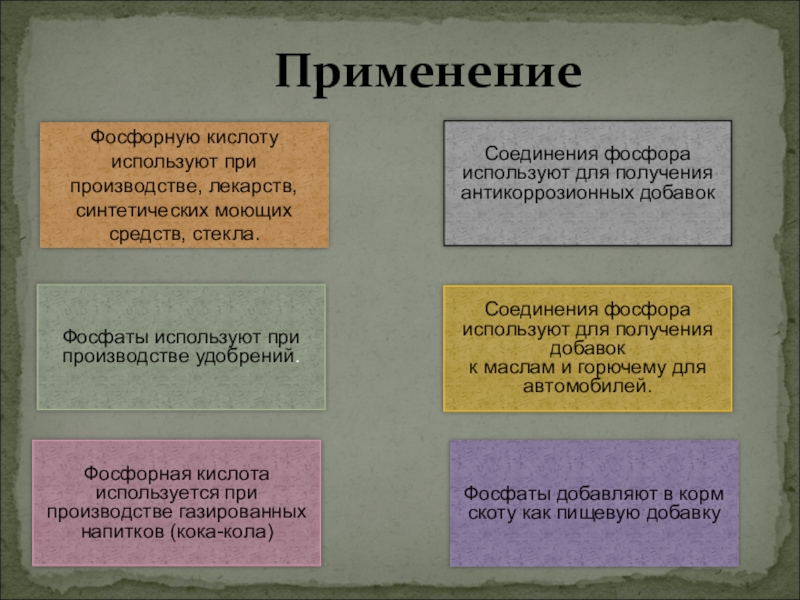
Слайд 26 Применение
Фосфаты добавляют
Фосфаты используют при производстве удобрений.
Соединения фосфора используют для получения антикоррозионных добавок
Фосфорную кислоту используют при производстве, лекарств,
синтетических моющих средств, стекла.
Соединения фосфора используют для получения добавок
к маслам и горючему для автомобилей.
Фосфорная кислота используется при производстве газированных напитков (кока-кола)
Слайд 27 литература
О.С.Габриелян ,
Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ Химия2000
http://ru.wikipedia.org/wiki/HNO3http://centralnyj.fis.ru/Petrochemicalshttp://dic.academic.ru/dic.nsf/bse/61981/%D0%90%D0%B7%D0%BE%D1
Горковенко М.Ю. Поурочные разработки по химии: 9 класс. – М.: ВАКО, 2010. – 368 с. – (В помощь школьному учителю).
Габриелян О.С. Химия. 9 класс: учеб. Для общеобразоват.учреждений/О.С.Габриелян. – 17-е изд.Б стереотип. –М.: Дрофа, 2010 – 270 с.:ил.