- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Азот (9 класс)
Содержание
- 1. Презентация по химии на тему Азот (9 класс)
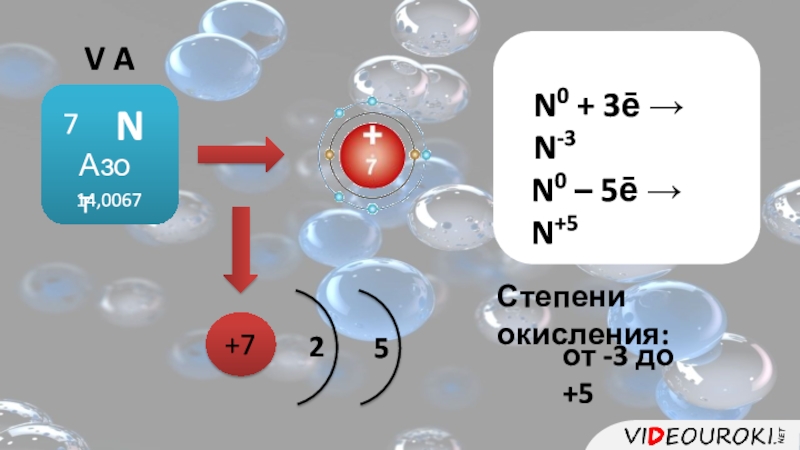
- 2. V AN0 + 3ē → N-3N0 – 5ē → N+5+725Степени окисления:от -3 до +5
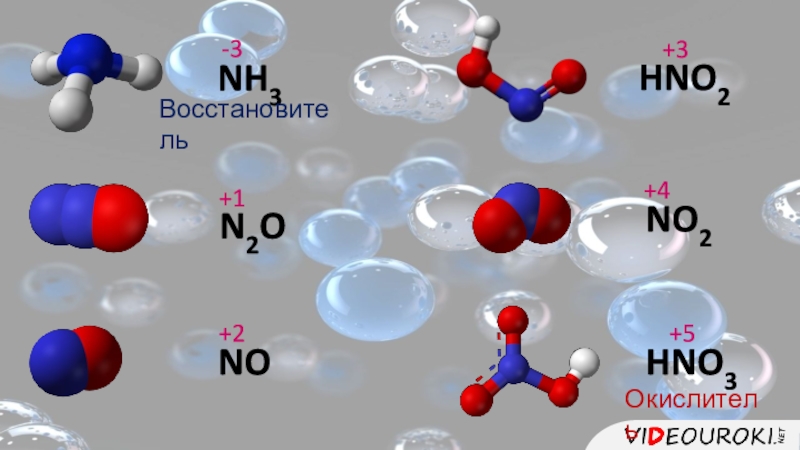
- 3. NH3-3N2O +1NO+2HNO2+3NO2 +4HNO3+5ВосстановительОкислитель
- 4. NaNO3
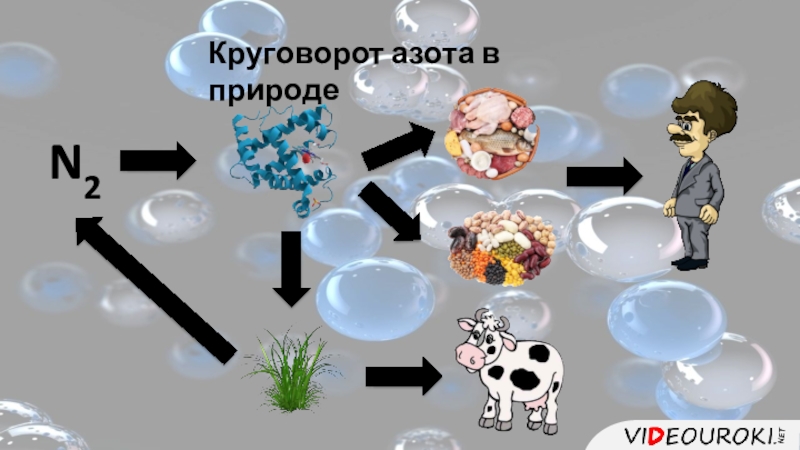
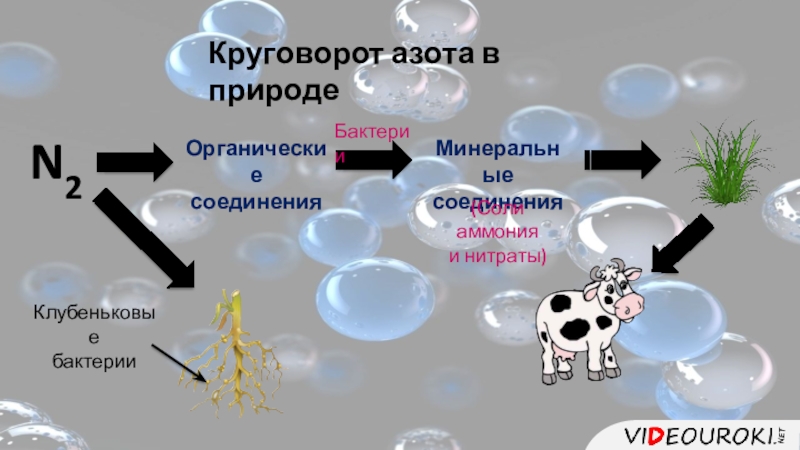
- 5. Круговорот азота в природеN2
- 6. Круговорот азота в природеN2Органические соединенияМинеральныесоединенияБактерии(Соли аммония и нитраты)Клубеньковые бактерии
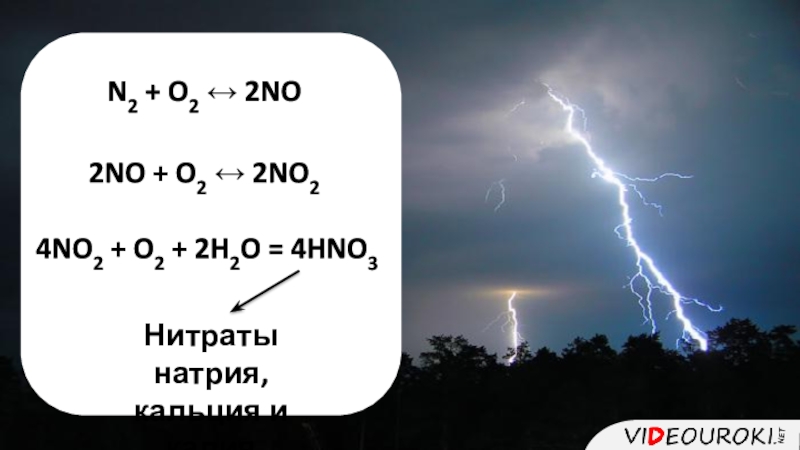
- 7. N2 + O2 ↔ 2NO2NO + O2
- 8. N2Азот – малоактивное вещество.Азот является бесцветным газом,
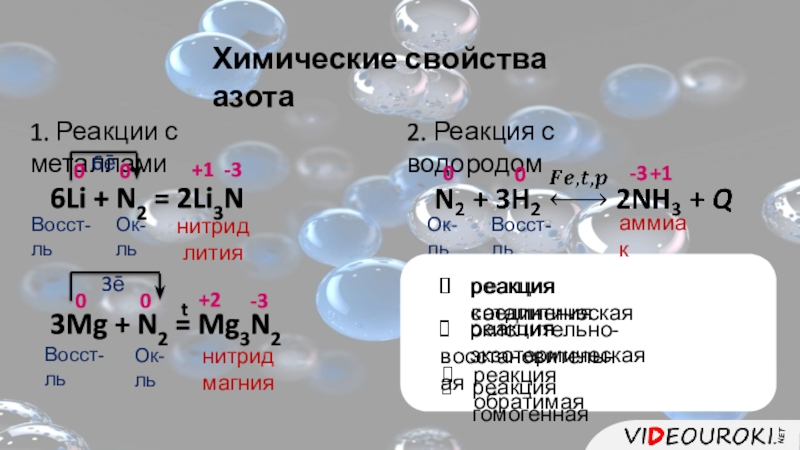
- 9. Химические свойства азота1. Реакции с металлами6Li +
- 10. 3. Реакция с кислородомХимические свойства азота00+2-2Восст-льоксид азота
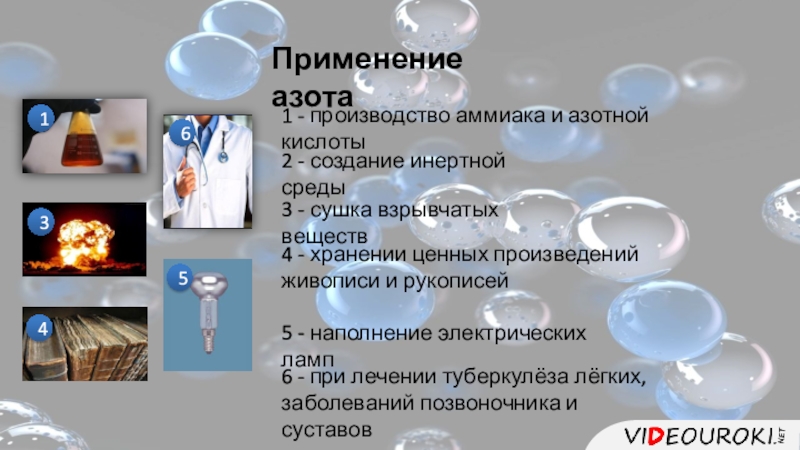
- 11. Применение азота11 - производство аммиака и азотной
- 12. Д. Резерфорд В 1772 г. в экспериментах
- 13. Определите массу соединения, которое образуется при нагревании
- 14. Определите массу соединения, которое образуется при нагревании
Слайд 6Круговорот азота в природе
N2
Органические
соединения
Минеральные
соединения
Бактерии
(Соли аммония
и нитраты)
Клубеньковые
бактерии
Слайд 8N2
Азот – малоактивное
вещество.
Азот является бесцветным газом, не имеет запаха и
Не сжижается при обычной температуре.
Азот плохо растворим в воде.
Температура плавления азота -210 0С, а температура кипения
-196 0С.
Слайд 9Химические свойства азота
1. Реакции с металлами
6Li + N2 = 2Li3N
0
0
+1
-3
6ē
Восст-ль
Ок-ль
3Mg +
0
0
+2
-3
нитрид
лития
нитрид
магния
3ē
Восст-ль
Ок-ль
2. Реакция с водородом
0
0
-3
+1
Восст-ль
Ок-ль
реакция соединения
реакция экзотермическая
реакция обратимая
реакция каталитическая
окислительно-
восстановительная
реакция гомогенная
t
аммиак
Слайд 103. Реакция с кислородом
Химические свойства азота
0
0
+2
-2
Восст-ль
оксид
азота (II)
Ок-ль
окислительно-
восстановительная
реакция соединения
реакция обратимая
реакция эндотермическая
реакция
реакция гомогенная
В реакциях с металлами и водородом азот проявляет окислительные свойства.
В реакциях с кислородом азот проявляет восстановительные свойства.
Слайд 11Применение азота
1
1 - производство аммиака и азотной кислоты
2
2 - создание инертной
3
3 - сушка взрывчатых веществ
4
4 - хранении ценных произведений живописи и рукописей
5
5 - наполнение электрических ламп
6
6 - при лечении туберкулёза лёгких, заболеваний позвоночника и суставов
Слайд 12Д. Резерфорд
В 1772 г.
в экспериментах
по сжиганию веществ
обнаружили
не поддерживающий
дыхание и горение.
К. Шееле
А. Лавуазье
В 1787 г. установил
наличие в воздухе газа,
не поддерживающего
дыхания и горения.
Он дал название
этому газу «азот»,
означающее
«безжизненный».
Ж. Шапталь
В 1790 г. дал азоту
другое название – нитрогениум – «рождающий селитру».
Слайд 13Определите массу соединения, которое образуется при нагревании металлического магния массой 7,2
Дано:
m (Mg) = 7,2 г
m (Mg3N2) - ?
Решение:
V (N2) = 10 л
3Mg + N2 = Mg3N2
t
M (Mg) = 24 г/моль
3 моль
1 моль
Азот в избытке
Слайд 14Определите массу соединения, которое образуется при нагревании металлического магния массой 7,2
Дано:
m (Mg) = 7,2 г
m (Mg3N2) - ?
Решение:
V (N2) = 10 л
3Mg + N2 = Mg3N2
t
3 моль
1 моль
1 моль
0,3 моль
0,1 моль
M (Mg3N2) = 24 · 3 + 14 · 2 = 100 г/моль
m = M · n
m (Mg3N2) = 0,1моль · 100 г/моль = 10 г
Ответ: m (Mg3N2) = 10 г