- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Азот. Соединения азота
Содержание
- 1. Презентация по химии на тему Азот. Соединения азота
- 2. Слайд 2
- 3. Содержание:История открытия. Получение азота.Соединения азота.Свойства азота.Азот в природе.Применение азота.
- 4. Слайд 4
- 5. История открытия:В 1772 году Генри Кавендиш провёл
- 6. Пристли в это время проводил серию экспериментов,
- 7. В 1772 году азот (под названием «испорченного
- 8. Название «Азот», предложил в 1787 году Антуан
- 9. Слайд 9
- 10. Получение:В лаборатории:при разложении нитрита аммония:NH4NO2 → N2↑
- 11. Самый чистый азот можно получить разложением азидов
- 12. Соединения Азота:Степени окисления азота в соединениях −3,
- 13. Слайд 13
- 14. Физические свойства:При нормальных условиях азот это бесцветный
- 15. Химические свойства:Ввиду своей значительной инертности азот при
- 16. Химические свойства:
- 17. Азот в природе:Изотопы азота:Природный азот состоит из
- 18. Распространённость:Вне пределов Земли азот обнаружен в газовых
- 19. Слайд 19
- 20. В результате процессов гниения
- 21. Слайд 21
- 22. Слайд 22
- 23. Применение:Промышленные применения газообразного азота обусловлены его инертными
- 24. Спасибо за внимание.
Содержание:История открытия. Получение азота.Соединения азота.Свойства азота.Азот в природе.Применение азота.
Слайд 3Содержание:
История открытия.
Получение азота.
Соединения азота.
Свойства азота.
Азот в природе.
Применение азота.
Слайд 5История открытия:
В 1772 году Генри Кавендиш провёл следующий опыт: он многократно
пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мифическим) воздухом .
Кавендиш выделил азот, но не сумел понять, что это новое простое вещество
Кавендиш выделил азот, но не сумел понять, что это новое простое вещество
Слайд 6Пристли в это время проводил серию экспериментов, в которых также связывал
кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона, совершенно неверно истолковал полученные результаты (по его мнению, процесс был противоположным — не кислород удалялся из газовой смеси, а наоборот, в результате обжига воздух насыщался флогистоном;
Слайд 7В 1772 году азот (под названием «испорченного воздуха») как простое вещество
описал Даниэль Резерфорд, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота.
Слайд 8Название «Азот», предложил в 1787 году Антуан Лавуазье.
Было известно, что азот
не поддерживает ни процесс горения, ни процесс дыхания. Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ.
Слайд 10Получение:
В лаборатории:
при разложении нитрита аммония:
NH4NO2 → N2↑ + 2H2O
при нагревании смеси
дихромата калия и сульфата аммония :
K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4
(NH4)2Cr2O7 → (t) →Cr2O3 + N2↑ + 4H2O
K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4
(NH4)2Cr2O7 → (t) →Cr2O3 + N2↑ + 4H2O
Слайд 11Самый чистый азот можно получить разложением азидов металлов:
2NaN3 →(t→)
2Na + 3N2↑
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом:
O2+ 4N2 + 2C → 2CO + 4N2
пропускание аммиака над оксидом меди (II) при температуре ~700 °C:
2NH3 + 3CuO → N2↑ + 3H2O + 3Cu
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом:
O2+ 4N2 + 2C → 2CO + 4N2
пропускание аммиака над оксидом меди (II) при температуре ~700 °C:
2NH3 + 3CuO → N2↑ + 3H2O + 3Cu
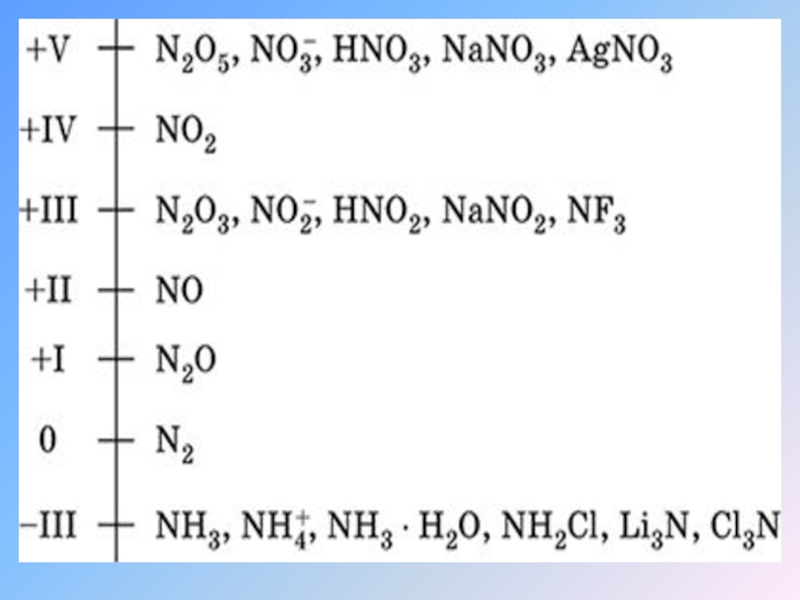
Слайд 12Соединения Азота:
Степени окисления азота в соединениях −3, −2, −1, +1, +2,
+3, +4, +5.
−3 представлены нитридами: NH3 (аммиак);
−2 представлены пернитридами, N2H4;
−1 NH2OH (гидроксиламин);
+1 веселящий газ, N2O (закись азота);
+2 оксид азота(II) NO (монооксид азота);
+3 оксид азота(III) N2O3, азотистая кислота, производные аниона NO2−, трифторид азота (NF3);
+4 оксид азота(IV) NO2(диоксид азота, бурый газ);
+5 оксид азота(V) N2O5, азотная кислота.
−3 представлены нитридами: NH3 (аммиак);
−2 представлены пернитридами, N2H4;
−1 NH2OH (гидроксиламин);
+1 веселящий газ, N2O (закись азота);
+2 оксид азота(II) NO (монооксид азота);
+3 оксид азота(III) N2O3, азотистая кислота, производные аниона NO2−, трифторид азота (NF3);
+4 оксид азота(IV) NO2(диоксид азота, бурый газ);
+5 оксид азота(V) N2O5, азотная кислота.
Слайд 14Физические свойства:
При нормальных условиях азот это бесцветный газ, не имеет запаха,
мало растворим в воде, плотность 1,2506 кг/м³ (при н.у.).
В жидком состоянии (темп. кипения −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
В жидком состоянии (темп. кипения −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
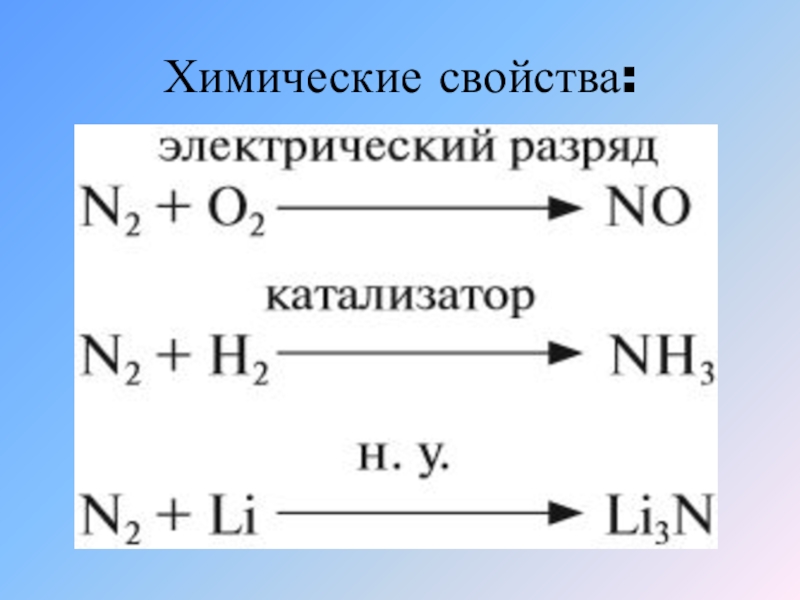
Слайд 15Химические свойства:
Ввиду своей значительной инертности азот при обычных условиях реагирует только
с литием:
6Li + N2 → 2Li3N.
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
3Mg + N2 → Mg3N2,
2B + N2 →2BN,
Обратимая реакция синтеза аммиака:
3H2 + N2 ↔ 2NH3
Карбида кальция с азотом при 1000 °C:
CaC2 + N2 → CaCN2 + C.
6Li + N2 → 2Li3N.
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
3Mg + N2 → Mg3N2,
2B + N2 →2BN,
Обратимая реакция синтеза аммиака:
3H2 + N2 ↔ 2NH3
Карбида кальция с азотом при 1000 °C:
CaC2 + N2 → CaCN2 + C.
Слайд 17Азот в природе:
Изотопы азота:
Природный азот состоит из двух стабильных изотопов 14N —
99,635 % и 15N — 0,365 %.
Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13N имеет период полураспада 10 мин.
Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13N имеет период полураспада 10 мин.
Слайд 18Распространённость:
Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на
Уране, Нептуне, межзвёздном пространстве и др. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).
Азот, в форме двухатомных молекул N2
составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму)
Азот, в форме двухатомных молекул N2
составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму)
Слайд 19
Биологическая роль:
Азот является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле — около 2,5 % (четвёртое место после водорода, углерода и кислорода
Азот является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2 %, по массовой доле — около 2,5 % (четвёртое место после водорода, углерода и кислорода
Слайд 20
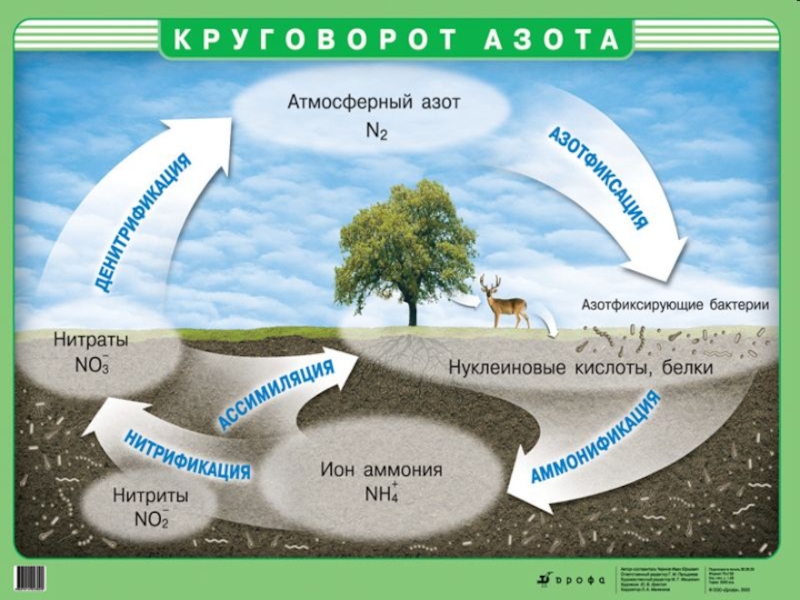
В результате процессов гниения и разложения азотсодержащей
органики, при условии благоприятных факторов окружающей среды, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры.
Слайд 23Применение:
Промышленные применения газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро-
и взрывобезопасен, препятствует окислению, гниению.
Газообразным азотом заполняют камеры шин.
В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы.
Газообразным азотом заполняют камеры шин.
В горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы.