- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Амфотерные химические соединения
Содержание
- 1. Презентация по химии на тему Амфотерные химические соединения
- 2. Амфотерность (переменность) – проявление
- 3. Амфотерными называются соединения
- 4. Амфотерность в свойствах проявляют оксиды металлов и
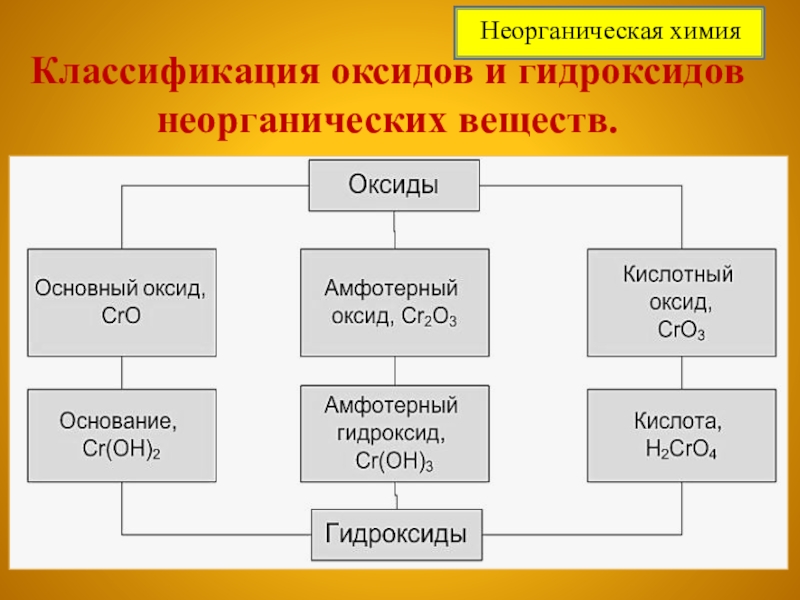
- 5. Классификация оксидов и гидроксидов неорганических веществ. Неорганическая химия
- 6. Амфотерные соединения : оксиды и
- 7. Амфотерные оксиды и гидроксиды некоторых элементов.H3ЭО3
- 8. Типичным амфотерным соединением является вода,
- 9. Неорганическая химия
- 10. Слайд 10
- 11. Некоторые оксиды и гидроксиды с кислотно-основными свойствами:Неорганическая химия
- 12. Комплексными называются соединения, в которых
- 13. Для объяснения строения и свойств
- 14. Органическая химия В органической
- 15. Именно амфотерность аминокислот обуславливает их
Слайд 2 Амфотерность (переменность) – проявление химическим соединением кислотных или
от среды реакции).
Слайд 3
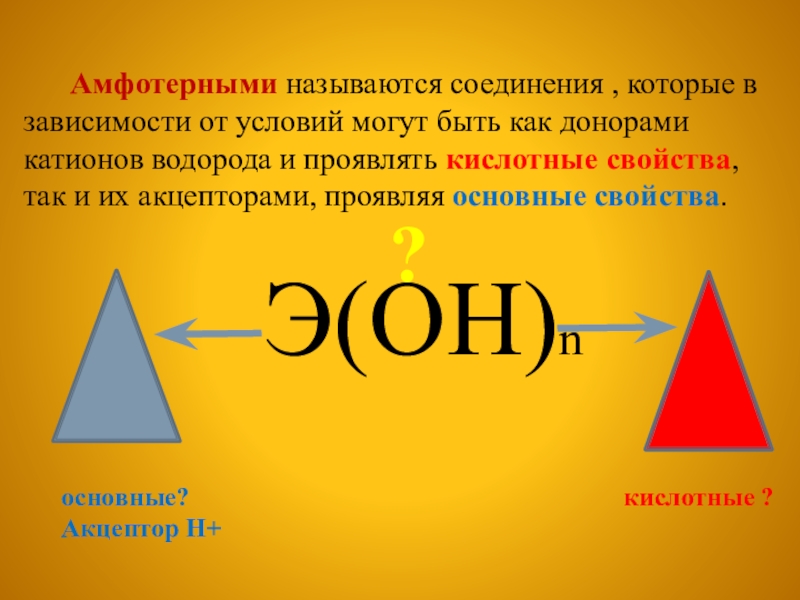
Амфотерными называются соединения , которые в зависимости
Э(OH)n
?
основные? кислотные ?
Акцептор Н+
Слайд 4
Амфотерность в свойствах проявляют оксиды металлов и их гидроксиды.
Обозначения:
оксиды
амфотерные
оксиды
кислотные
оксиды
Неорганическая химия
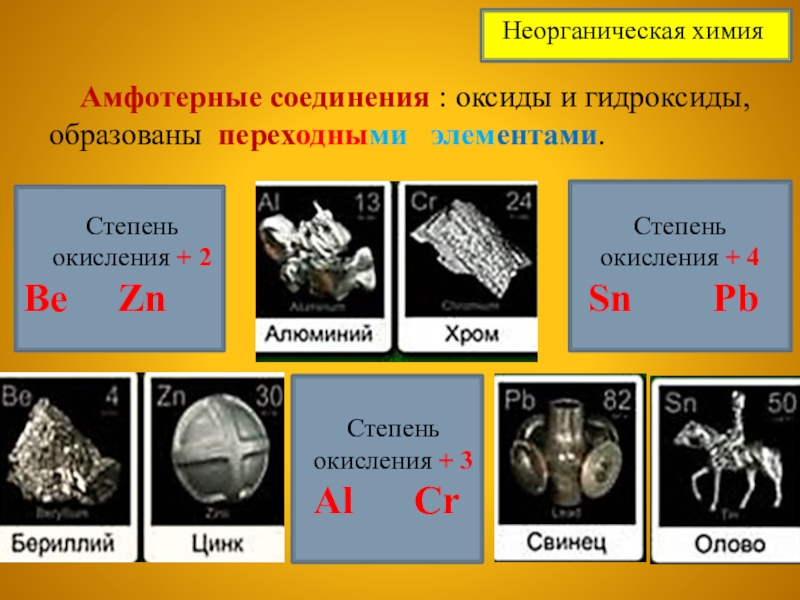
Слайд 6 Амфотерные соединения : оксиды и гидроксиды, образованы переходными
Степень окисления + 2
Be Zn
Степень окисления + 3
Al Cr
Степень окисления + 4
Sn Pb
Неорганическая химия
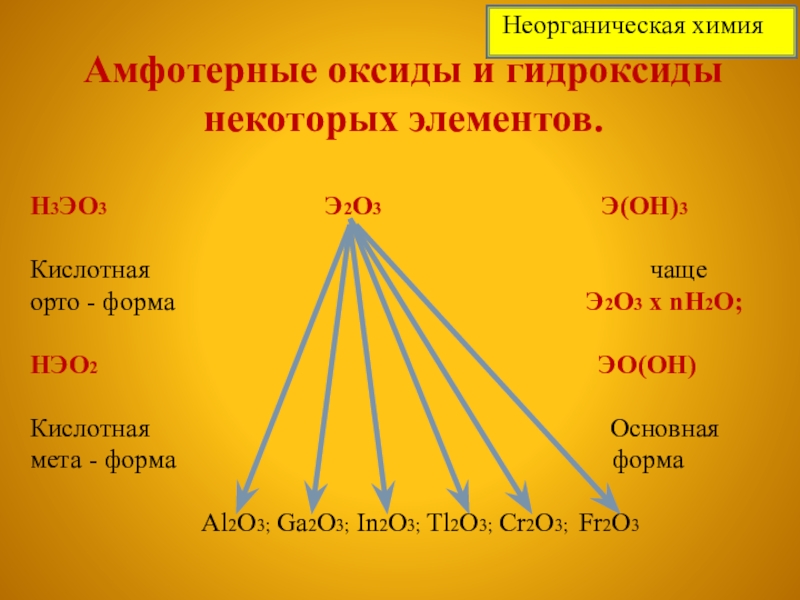
Слайд 7Амфотерные оксиды и гидроксиды некоторых элементов.
H3ЭО3
Кислотная чаще
орто - форма Э2О3 х nH2O;
НЭО2 ЭО(ОН)
Кислотная Основная
мета - форма форма
Al2O3; Ga2O3; In2O3; Tl2O3; Cr2O3; Fr2O3
Неорганическая химия
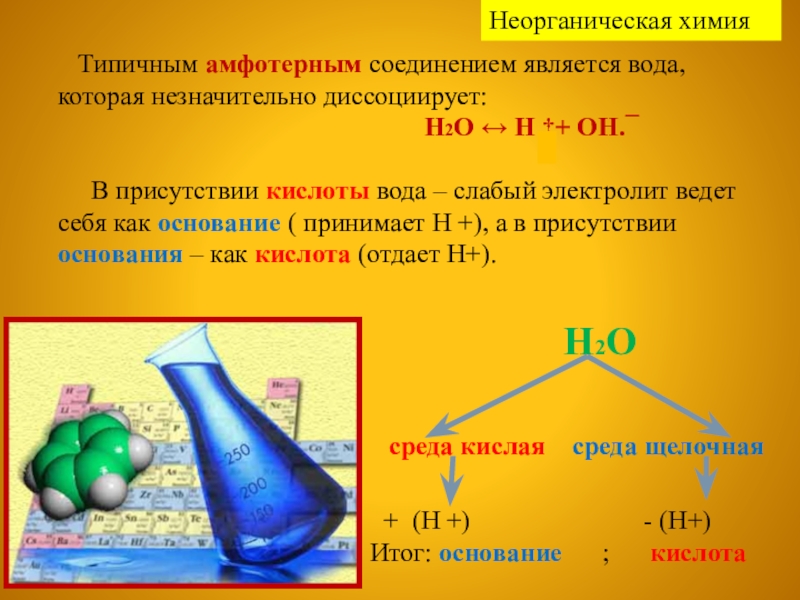
Слайд 8 Типичным амфотерным соединением является вода, которая незначительно диссоциирует:
В присутствии кислоты вода – слабый электролит ведет себя как основание ( принимает Н +), а в присутствии основания – как кислота (отдает Н+).
Н2О
среда кислая среда щелочная
+ (Н +) - (Н+)
Итог: основание ; кислота
Неорганическая химия
Слайд 9Неорганическая химия
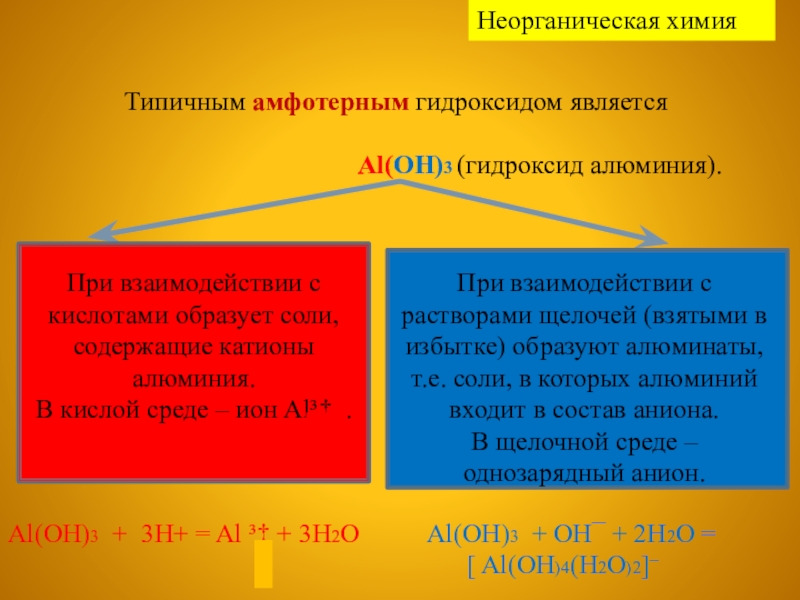
Типичным амфотерным гидроксидом является
Al(OH)3 (гидроксид алюминия).
При взаимодействии с кислотами образует соли, содержащие катионы алюминия.
В кислой среде – ион Al³‡...
При взаимодействии с растворами щелочей (взятыми в избытке) образуют алюминаты, т.е. соли, в которых алюминий входит в состав аниона.
В щелочной среде – однозарядный анион.
Al(OH)3 + 3H+ = Al ³‡ + 3H2O
Al(OH)3 + OH¯ + 2H2O =
[ Al(OH)4(H2O)2]¯
Слайд 10
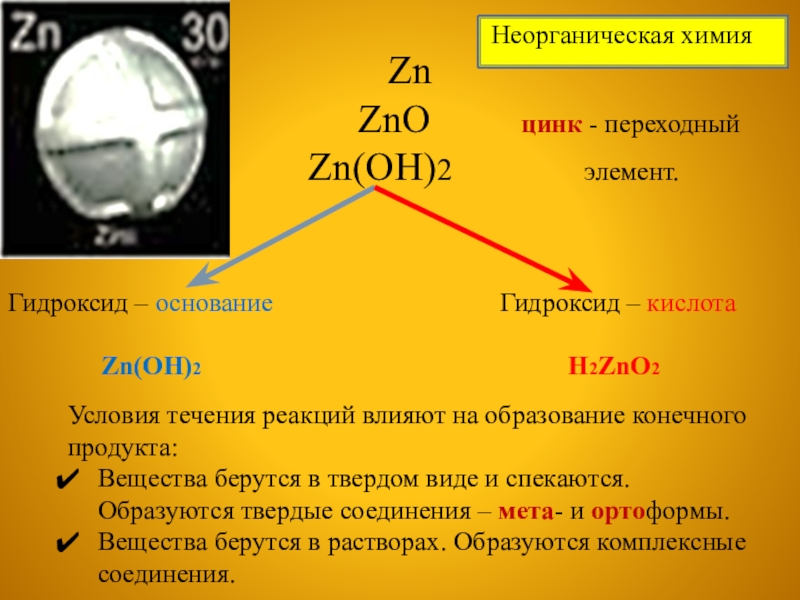
ZnO цинк - переходный
Zn(OH)2 элемент.
Гидроксид – основание Гидроксид – кислота
Zn(OH)2 H2ZnO2
Условия течения реакций влияют на образование конечного продукта:
Вещества берутся в твердом виде и спекаются. Образуются твердые соединения – мета- и ортоформы.
Вещества берутся в растворах. Образуются комплексные соединения.
Неорганическая химия
Слайд 12 Комплексными называются соединения, в которых хоты бы одна ковалентная
В переводе с латинского complexus означает «сочетание».
NH3 + HCl = [ NH4]Cl
хлорид аммония
C6H5NН2 + HCl = [C6H5NH3]Cl
! Назовите вещество.
Неорганическая химия
Слайд 13
Для объяснения строения и свойств комплексных соединений в 1893
Альфред Вернер
(1866 – 1919)
Неорганическая химия
Слайд 14Органическая химия
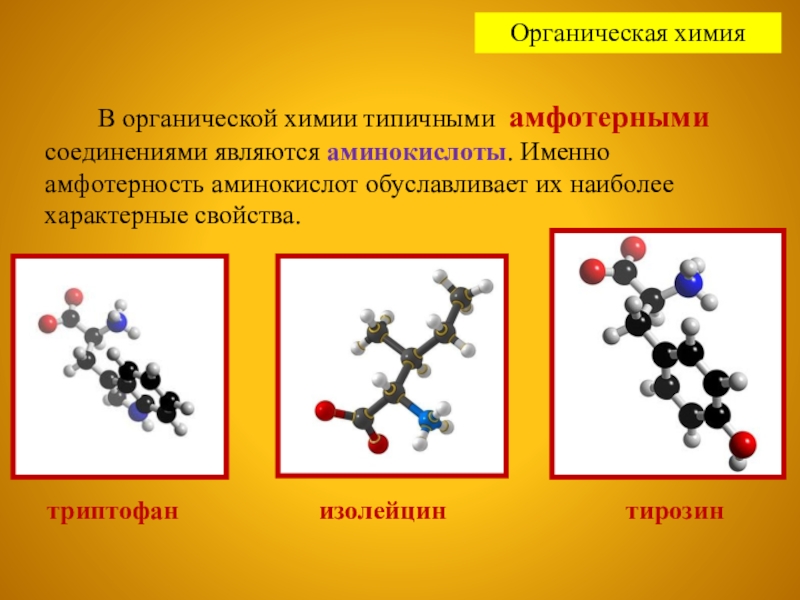
В органической химии типичными амфотерными соединениями
триптофан изолейцин тирозин
Слайд 15 Именно амфотерность аминокислот обуславливает их наиболее характерные свойства.
Способности
NH2 – CH – COOH [ + NH3 – CH – COO¯]
R R
диполярный ион
Аминокислоты могут вступать друг с другом в реакции поликонденсации, образуя полипептиды и белки (важные клеточные процессы).
Органическая химия