физиком
Х.К. Эрстедом, основоположником учения о электромагнетизме.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Алюминий
Содержание
- 1. Презентация по химии на тему: Алюминий
- 2. Ф. Вёлер1800–1882 гг.Выделил металлический алюминий иным и
- 3. Анри Сент-Клер Девиль1811–1881 гг.Разработал другой химический процесс
- 4. Слайд 4
- 5. Название элемента образовано от латинского alumen —
- 6. До открытия промышленного способа получения алюминия этот
- 7. MaterialscientistФизические свойства алюминия
- 8. Температура плавления алюминия довольно низкая (660 °C).Алюминий
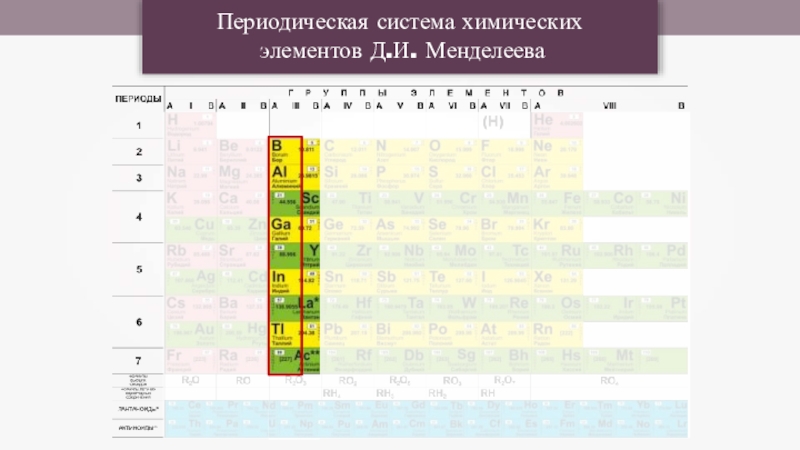
- 9. Периодическая система химическихэлементов Д.И. Менделеева
- 10. Слайд 10
- 11. Li, K, Ba, Ca, Na, Mg, Al,
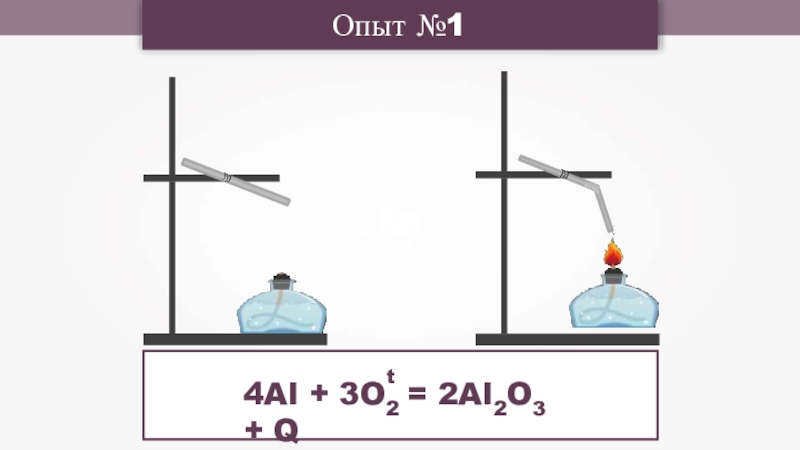
- 12. Опыт №14Al + 3O2 = 2Al2O3 + Qt
- 13. Алюминий легко реагирует с неметаллами, реакции проходят
- 14. 2Al + 3Br2 = 2AlBr30 0 +3 –1Бромид алюминия6e–При взаимодействии алюминия с бромомполучаем бромид алюминия.
- 15. 2Al + 3S = Al2S30 0 +3 –2tСульфид алюминия6e–При взаимодействии алюминия с серойполучаем сульфид алюминия.
- 16. 4Al + 3С = Al4С30 0 +3 –4tКарбид алюминия12e–При взаимодействии алюминия суглеродом образуется карбид алюминия.
- 17. Реакция алюминия с водой2Al + 6H2O = 2Al(OH)3 + 3H2
- 18. Реакция алюминия со щелочами2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
- 19. Опыт №22Al + 6HCl = 2AlCl3 + 3H2↑2Al + 3H2SO4(разб.)= Al2(SO4)3 + 3H2↑
- 20. С концентрированной азотной и серной кислотой алюминий
- 21. Метод алюминотермии8Al + 3Fe3O4 = 4Al2O3 + 9Fet
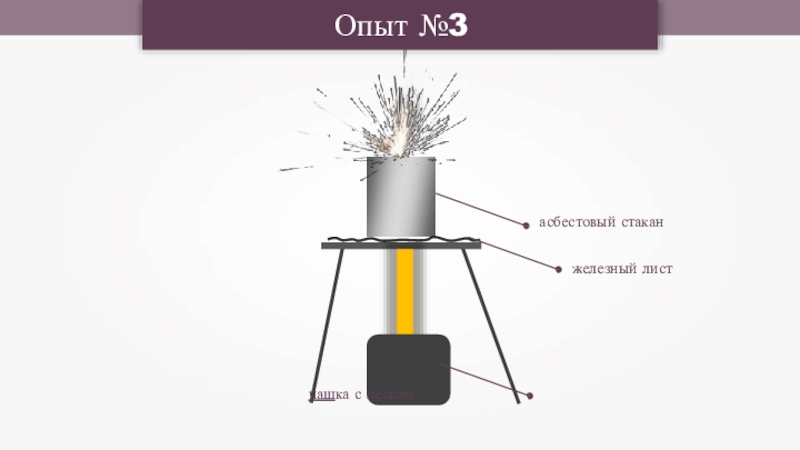
- 22. Опыт №3асбестовый стаканжелезный лист чашка с песком
- 23. Амфотерный характер оксида алюминия и особенности свойств
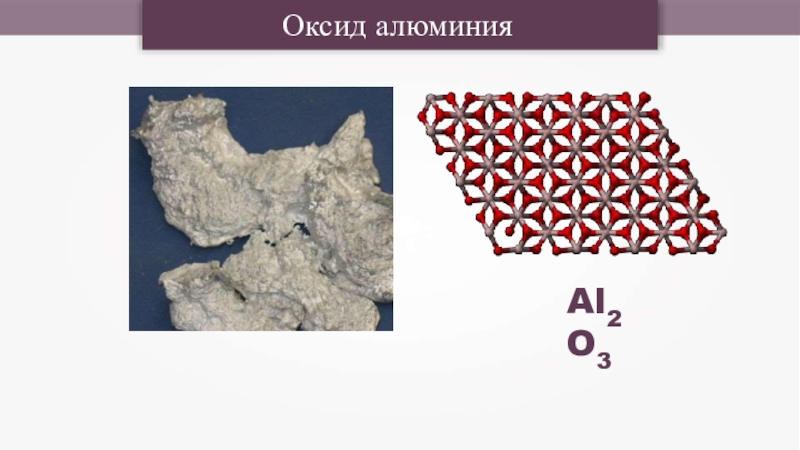
- 24. Оксид алюминияAl2O3
- 25. Корунд
- 26. Al2O3+6HCl=2AlCl3+3H2OОксид алюминия не растворяется в воде и
- 27. По отношению к щелочам оксид алюминия ведет
- 28. Гидроксид алюминияAl(OH)3
- 29. Получение гидроксида алюминияAlCl3+3NaOH=Al(OH)3+3NaCl
- 30. Если на гидроксид алюминия подействовать какой-либо кислотой,
- 31. Алюминий в природе
- 32. По распространённости в земной коре среди металлов
- 33. Природные соединения, содержащие алюминийАлюмосиликатыБокситы
- 34. Слайд 34
- 35. АлюмосиликатыЭти соединения можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных и щёлочноземельных металлов.
- 36. Бокситы
- 37. Применение алюминия
- 38. Слайд 38
- 39. Слайд 39
- 40. Слайд 40
- 41. Высокая электрическая проводимость чистого алюминия используется в электротехнике.
- 42. Слайд 42
- 43. Серебряная краска
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
Ф. Вёлер1800–1882 гг.Выделил металлический алюминий иным и более эффективным методом: нагреванием безводного хлорида алюминия не с амальгамой калия, а просто с металлическим калием.
Слайд 2Ф. Вёлер
1800–1882 гг.
Выделил металлический алюминий иным и более эффективным методом: нагреванием
безводного хлорида алюминия не с амальгамой калия, а просто с металлическим калием.
Слайд 3Анри Сент-Клер Девиль
1811–1881 гг.
Разработал другой химический процесс получения алюминия: хлористый алюминий
нагревали с натрием, который вытеснял алюминий из соли, заставляя его выделяться в виде небольших корольков.
Слайд 5Название элемента образовано от латинского alumen — квасцы.
Данный элемент носил несколько
названий. Так, Дэви, предполагая присутствие его в глинозёме, называл его алюмиумом или алюминумом.
В русской химической литературе 19 века встречаются следующие названия алюминия: глинозём, алумий, алюминий и глиний.
В русской химической литературе 19 века встречаются следующие названия алюминия: глинозём, алумий, алюминий и глиний.
Слайд 6До открытия промышленного способа получения алюминия этот металл был дороже золота.
В
1889 г. британцы, желая почтить богатым подарком великого русского химика Д.И. Менделеева, подарили ему весы из золота и алюминия.
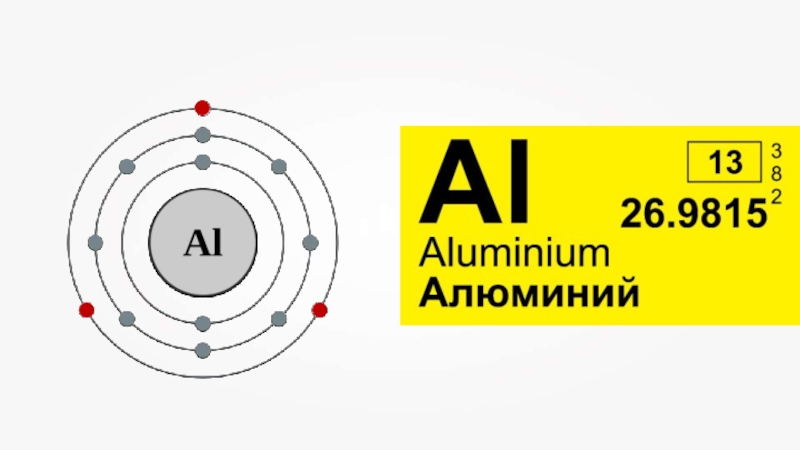
Слайд 8Температура плавления алюминия довольно низкая (660 °C).
Алюминий — хороший проводник
теплоты и
электрического тока.
Имеет высокую пластичность, в следствие чего легко вытягивается в проволоку и прокатывается в фольгу до 0,001 мм.
Имеет высокую пластичность, в следствие чего легко вытягивается в проволоку и прокатывается в фольгу до 0,001 мм.
Слайд 11Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe,
Co, Sn, Pb, H, Cu, Hg, Ag, Au
В электрохимическом ряду напряжений металлов алюминий близок к щелочным
и щёлочноземельным металлам и проявляет себя как химически активный металл.
Слайд 13Алюминий легко реагирует с неметаллами, реакции проходят бурно с выделением большого
количества теплоты, но для начала реакции необходимо нагреть элементы (исключение составляют галогены — хлор и бром).
Слайд 142Al + 3Br2 = 2AlBr3
0 0 +3 –1
Бромид алюминия
6e–
При взаимодействии алюминия с бромом
получаем бромид
алюминия.
Слайд 152Al + 3S = Al2S3
0 0 +3 –2
t
Сульфид алюминия
6e–
При взаимодействии алюминия с серой
получаем сульфид
алюминия.
Слайд 164Al + 3С = Al4С3
0 0 +3 –4
t
Карбид алюминия
12e–
При взаимодействии алюминия с
углеродом образуется карбид
алюминия.
Слайд 20С концентрированной азотной и серной кислотой алюминий при обычной температуре не
реагирует.
Поэтому их кислоту можно перевозить в алюминиевых цистернах.
Поэтому их кислоту можно перевозить в алюминиевых цистернах.
Слайд 23Амфотерный характер оксида алюминия и особенности свойств соединения показывают, что металлические
свойства у алюминия выражены несколько слабее, чем у таких типичных металлов, как щелочные и щёлочноземельные.
Слайд 26
Al2O3+6HCl=2AlCl3+3H2O
Оксид алюминия не растворяется в воде и не реагирует с ней.
Оксид алюминия амфотерен.
По отношению к кислотам он ведет себя как основный оксид:
растворяется в растворах кислот с образованием солей.
По отношению к кислотам он ведет себя как основный оксид:
растворяется в растворах кислот с образованием солей.
Слайд 27По отношению к щелочам оксид алюминия ведет себя как кислотный оксид.
Al2O3
+ 2NaOH + 3H2O → 2Na[Al(OH)4]
Тетрагидроксоалюминат натрия
Тетрагидроксоалюминат натрия
Слайд 30Если на гидроксид алюминия подействовать какой-либо кислотой, например, соляной, то осадок
исчезнет и получится прозрачный раствор: происходит реакция с образованием растворимой в воде соли алюминия и воды.
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Слайд 32По распространённости в земной коре среди металлов занимает первое место и
третье место после кислорода и водорода среди всех элементов.
Materialscientist
Слайд 35Алюмосиликаты
Эти соединения можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных
и щёлочноземельных металлов.














![Презентация по химии на тему: Алюминий Реакция алюминия со щелочами2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 Реакция алюминия со щелочами2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2](/img/thumbs/5c4ad9ad72d2c266626be9cc32f3f655-800x.jpg)






![Презентация по химии на тему: Алюминий По отношению к щелочам оксид алюминия ведет себя как кислотный оксид.Al2O3 По отношению к щелочам оксид алюминия ведет себя как кислотный оксид.Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]Тетрагидроксоалюминат](/img/thumbs/75493e6fc2d12cebfd4ed3526434dd45-800x.jpg)
























