- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Молярная масса
Содержание
- 1. Презентация по химии Молярная масса
- 2. Цели урока: Сформировать понятие о молярной массе
- 3. Ответим на вопросы:Что такое моль?Какой буквой обозначается
- 4. Определение: Молярная масса-величина, равная отношению массы вещества(m)
- 5. Задача. Вычислить количество вещества хлороводорода массой 73г.Форма
- 6. 1.В год человек употребляет в пищу поваренную
- 7. 5.Ежегодно на нашу Землю падает больше тысячи
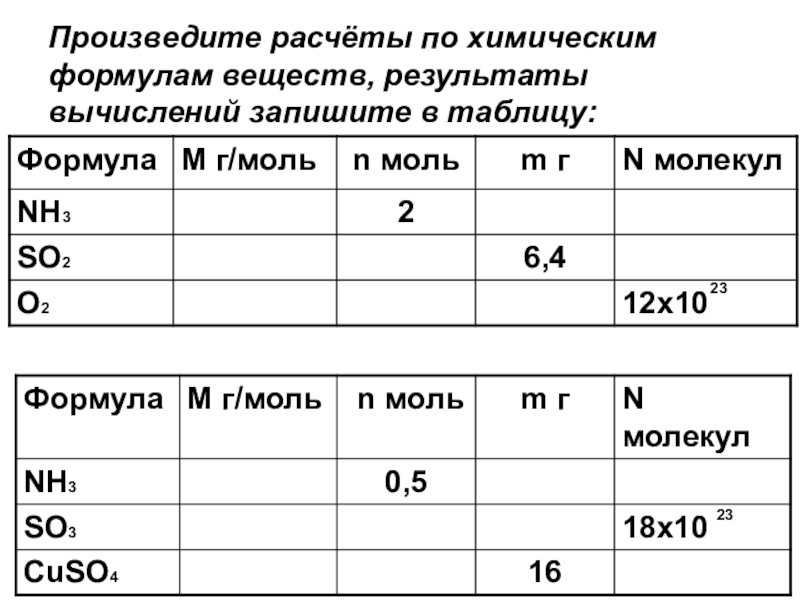
- 8. Произведите расчёты по химическим формулам веществ, результаты вычислений запишите в таблицу:2323
Цели урока: Сформировать понятие о молярной массе и единицах её измерения.Показать взаимосвязь понятий: масса, количество вещества, молярная масса.Научить производить расчёты с использованием понятий: масса, количество вещества, молярная масса.
Слайд 2Цели урока:
Сформировать понятие о молярной массе и единицах её измерения.
Показать взаимосвязь
понятий: масса, количество вещества, молярная масса.
Научить производить расчёты с использованием понятий: масса, количество вещества, молярная масса.
Научить производить расчёты с использованием понятий: масса, количество вещества, молярная масса.
Слайд 3Ответим на вопросы:
Что такое моль?
Какой буквой обозначается количество вещества?
В каких единицах
измеряется количество вещества?
Чему равно число Авогадро?
Сколько молекул содержат 2моль водорода?
Чему равно число Авогадро?
Сколько молекул содержат 2моль водорода?
Слайд 4Определение: Молярная масса-величина, равная отношению массы вещества(m) к количеству вещества(n).
M=m/n
m=M n
n=m/M
M
– молярная масса.
m– масса вещества.
n – количество вещества.
m– масса вещества.
n – количество вещества.
Единицы измерения: г/моль, кг/моль.
Числовое значение молярной массы(М в г/моль) равно числовому значению относительной атомной (Аr) или относительной молекулярной массы(Мr) вещества. М(N)=14 г/моль М(N2)=28 г/моль
Слайд 5Задача. Вычислить количество вещества хлороводорода массой 73г.
Форма записи задачи:
Найти:
n(HCl)
Дано:
m(HCl)=73г
М(HCl)=36,5г/моль
М=m/n
n=m/M
n(HCl)=73г/36,5г/моль==2моль
Ответ: Количество вещества
хлороводорода массой 73г составляет 2 моль.
Слайд 61.В год человек употребляет в пищу поваренную соль массой 7кг. Какое
количество вещества хлорида натрия составляет эту массу?
2.Железный гвоздь имеет массу 5,6г. Какое количество вещества железа это составляет?
3.Мировые запасы золота – около 20 000т.Какое количество вещества золота это составляет?
4.Листовая поверхность площадью 1кв.м может ассимилировать за час углекислый газ количеством вещества 0,04 моль. Какой массе углекислого газа это соответствует?
2.Железный гвоздь имеет массу 5,6г. Какое количество вещества железа это составляет?
3.Мировые запасы золота – около 20 000т.Какое количество вещества золота это составляет?
4.Листовая поверхность площадью 1кв.м может ассимилировать за час углекислый газ количеством вещества 0,04 моль. Какой массе углекислого газа это соответствует?
Решим задачи:
Слайд 75.Ежегодно на нашу Землю падает больше тысячи метеоритов. Самый большой железный
метеорит количеством вещества 1,07x1000000 моль был найден в 1920 году в юго-западной части Африки. Какова масса этого метеорита?
6.На 1га пашни под картофель вносят в качестве удобрения калийную селитру количеством вещества 0,5x1000 моль. Какова масса (в мг) этого удобрения?
7.Что тяжелее: вода количеством вещества 5 моль или серная кислота количеством вещества 1 моль?
8.На одну чашку весов положили оксид железа(III) количеством вещества 0,5 моль. Какую массу оксида меди(II) надо положить на другую чашку весов, чтобы они были в равновесии?
6.На 1га пашни под картофель вносят в качестве удобрения калийную селитру количеством вещества 0,5x1000 моль. Какова масса (в мг) этого удобрения?
7.Что тяжелее: вода количеством вещества 5 моль или серная кислота количеством вещества 1 моль?
8.На одну чашку весов положили оксид железа(III) количеством вещества 0,5 моль. Какую массу оксида меди(II) надо положить на другую чашку весов, чтобы они были в равновесии?