- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Металлическая химическая связь (11 кл., профильный уровень)
Содержание
- 1. Презентация по химии Металлическая химическая связь (11 кл., профильный уровень)
- 2. Особенности строения атомов металлову атомов Ме на
- 3. Образование Ме-связи→При образовании кристаллической решетки атомы Ме
- 4. Образование связи у переходных Мечасть валентных ē
- 5. Металлическая кристаллическая решетка(+)атом-ионы(–) «электронный газ»Ме0 - nē
- 6. Варианты металлических кристаллических решеток существует несколько
- 7. Прочность металлической кристаллической решетки существует понятие энергии
- 8. Свойства Ме-связиненаправленность;ненасыщаемость;у атомов Ме имеется избыток свободных
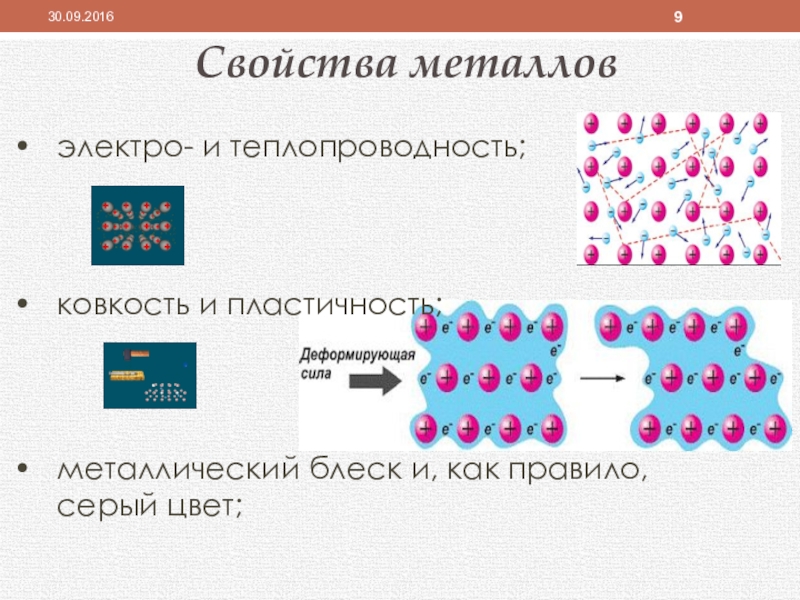
- 9. электро- и теплопроводность;ковкость и пластичность;металлический блеск и, как правило, серый цвет;Свойства металлов
- 10. Домашнее задание§3, стр 33записи
Слайд 2Особенности строения атомов металлов
у атомов Ме на внешнем электронном уровне 1-3
у атомов Ме сравнительно большой радиус атома
атомы Ме имеют большое число свободных орбиталей:
искл.: №32 Ge, №50 Sn, №82 Pb
№51 Sb, №83 Bi
№84 Po
ē слабо притягиваются к ядру и легко могут «уходить» с уровня
8 свободных орбиталей
Слайд 3Образование Ме-связи
→
При образовании кристаллической решетки атомы Ме сближаются до касания, валентные
В результате этого образуются обобществлённые свободные ē, которые непрерывно перемещаются между (+)заряженными ионами узлов такой решетки, электростатически связывая их в единое целое.
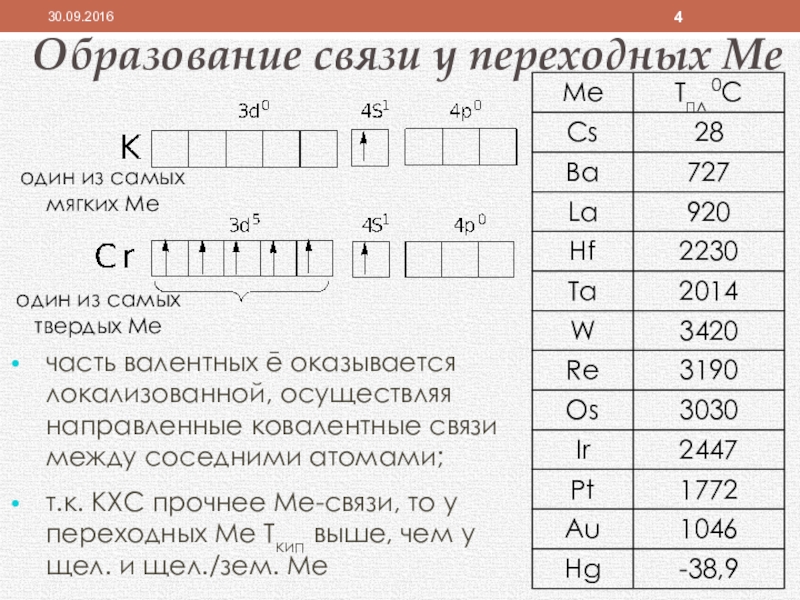
Слайд 4Образование связи у переходных Ме
часть валентных ē оказывается локализованной, осуществляя направленные
т.к. КХС прочнее Ме-связи, то у переходных Ме Ткип выше, чем у щел. и щел./зем. Ме
один из самых мягких Ме
один из самых твердых Ме
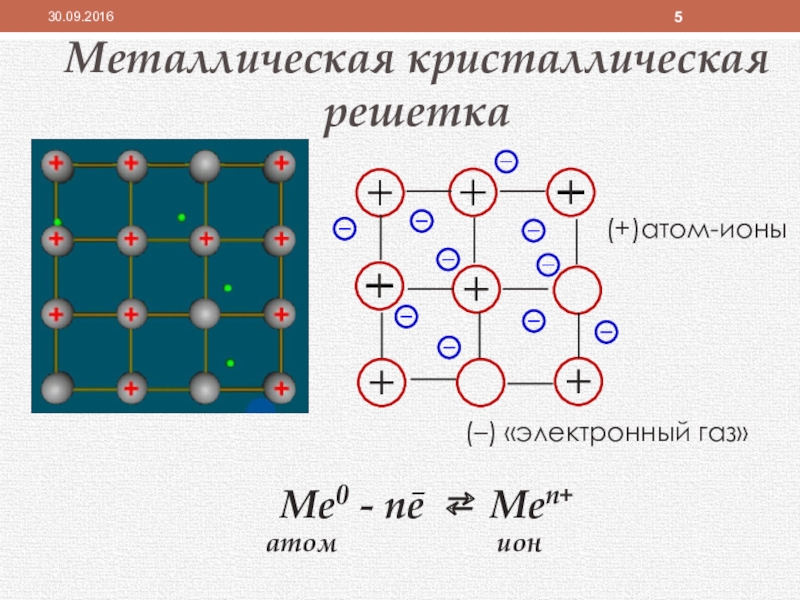
Слайд 5Металлическая кристаллическая решетка
(+)атом-ионы
(–) «электронный газ»
Ме0 - nē ⇄ Men+
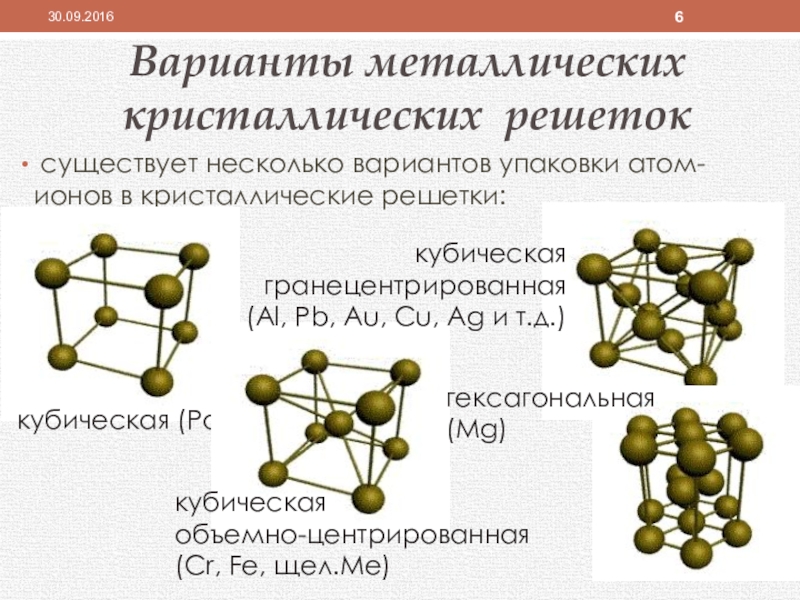
Слайд 6Варианты металлических
кристаллических решеток
существует несколько вариантов упаковки атом-ионов в кристаллические
кубическая (Ро)
кубическая
объемно-центрированная
(Cr, Fe, щел.Ме)
кубическая
гранецентрированная
(Al, Pb, Au, Cu, Ag и т.д.)
гексагональная
(Mg)
Слайд 7Прочность металлической кристаллической решетки
существует понятие энергии металлической кристаллической решетки (Е,
Екр.реш. зависит от размера катиона, его заряда и упаковки в решетке:
наибольшей Екр.реш. обладают решетки, состоящие из небольших ионов с большим зарядом;
сверху вниз в подгруппе Екр.реш. уменьшается, т.к. увеличивается размер ионов;
в периоде слева направо Екр.реш. возрастает из-за увеличения заряда иона
Слайд 8Свойства Ме-связи
ненаправленность;
ненасыщаемость;
у атомов Ме имеется избыток свободных орбиталей по отношению к
слабее ковалентной и ионной;
ненаправленность и ненасыщаемость Ме-связи определяют все наиболее характерные свойства Ме