- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Кислоты 8 класс
Содержание
- 1. Презентация по химии Кислоты 8 класс
- 2. Кислоты - сложные вещества, состоящие из одного
- 3. Слайд 3
- 4. Каждой кислоте соответствует свой кислотный оксид. При
- 5. Названия кислот
- 6. Названия кислот и кислотных остатков
- 7. Многие кислоты, например серная ,
- 8. Химические свойстваИзменяют цвет индикатора
- 9. Химические свойстваFe + 2 HCl = FeCl2 + H2 +2Металлы, стоящие в ряду напряжений
- 10. Слайд 10
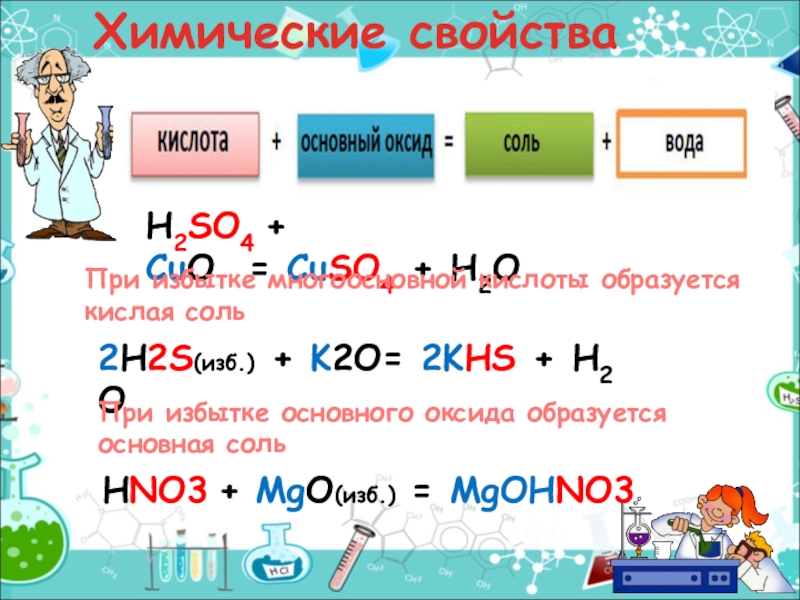
- 11. Химические свойстваH2SO4 + CuO = CuSO4 + H2O2H2S(изб.) + K2O= 2KHS + H2OHNO3 + MgO(изб.) = MgOHNO3 При
- 12. Слайд 12
- 13. Химические свойстваН2SО4 + 2NaOH = Na2SO4 + 2H2OН2SО4 + Mg(OH)2 = MgSO4 + 2H2OРеакция нейтрализации
- 14. Слайд 14
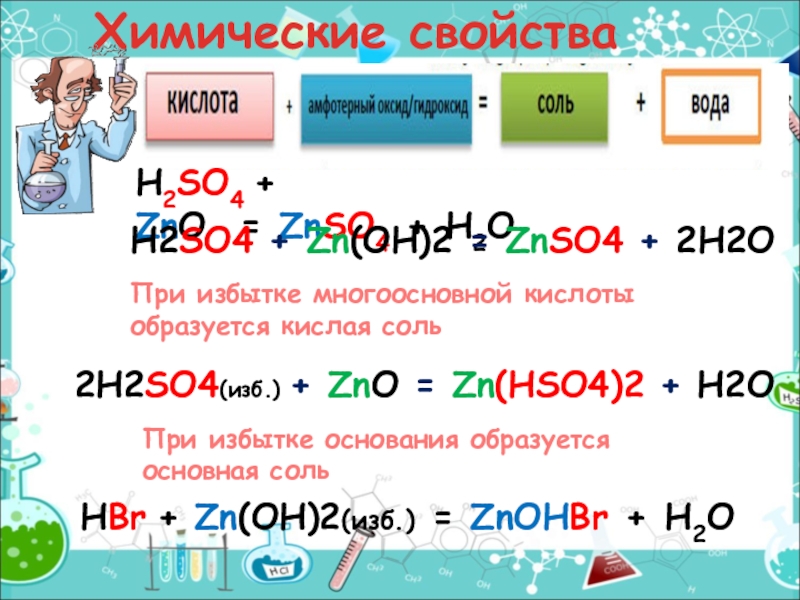
- 15. Химические свойстваH2SO4 + ZnO = ZnSO4 + H2OН2SО4 + Zn(OH)2 =
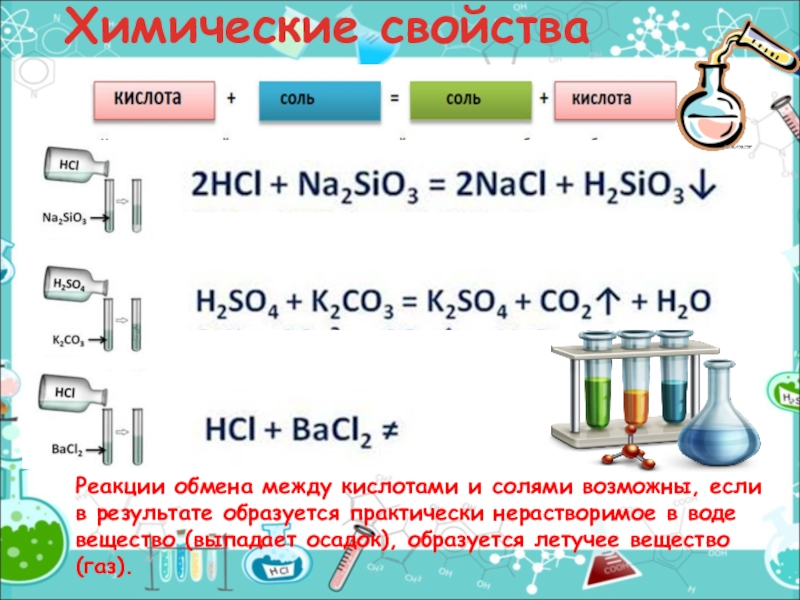
- 16. Химические свойстваРеакции обмена между кислотами и солями
- 17. Слайд 17
- 18. Более сильная кислота, вытесняет менее сильную из ее соли.Ряд активности кислот:AgNO3 + HCl = AgCl↓ + HNO3
- 19. Химические свойстваМногие кислородсодержащие кислоты разлагаются при нагревании.
- 20. Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются
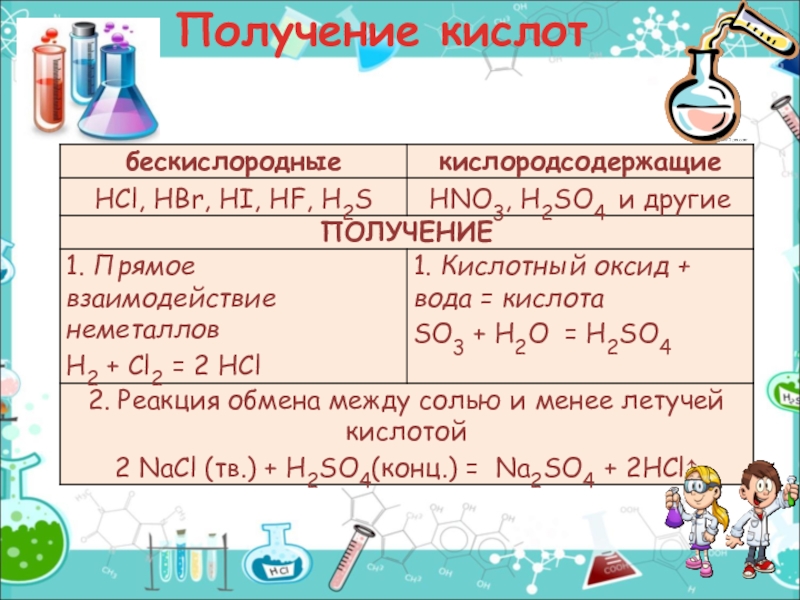
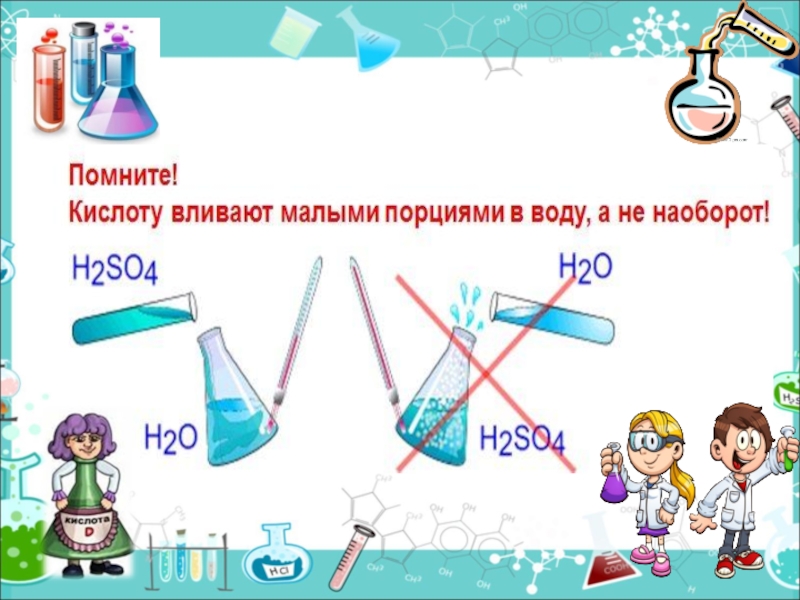
- 21. Получение кислот
- 22. Слайд 22
Слайд 2Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода,
НnА
- n
Слайд 4Каждой кислоте соответствует свой кислотный оксид. При этом валентность центрального атома
I IV II IV II
Н2SO3 SO2
Валентность кислотного остатка определяется по количеству атомов водорода в кислоте!
Слайд 7Многие кислоты, например серная , азотная HNO3,
Физические свойства
Слайд 9Химические свойства
Fe + 2 HCl = FeCl2 + H2
+2
Металлы, стоящие в ряду напряжений до водорода, могут вытеснять
Cu + HCl = реакции нет
Слайд 11Химические свойства
H2SO4 + CuO = CuSO4 + H2O
2H2S(изб.) + K2O= 2KHS + H2O
HNO3 + MgO(изб.) = MgOHNO3
При избытке многоосновной кислоты образуется
При избытке основного оксида образуется основная соль
Слайд 13Химические свойства
Н2SО4 + 2NaOH = Na2SO4 + 2H2O
Н2SО4 + Mg(OH)2 =
Реакция нейтрализации
Слайд 15Химические свойства
H2SO4 + ZnO = ZnSO4 + H2O
Н2SО4 + Zn(OH)2 = ZnSO4 + 2H2O
2Н2SО4(изб.) +
HBr + Zn(OH)2(изб.) = ZnOHBr + H2O
При избытке многоосновной кислоты образуется кислая соль
При избытке основания образуется основная соль
Слайд 16Химические свойства
Реакции обмена между кислотами и солями возможны, если в результате
Слайд 18Более сильная кислота, вытесняет менее сильную из ее соли.
Ряд активности кислот:
AgNO3 + HCl = AgCl↓
Слайд 19Химические свойства
Многие кислородсодержащие кислоты разлагаются при нагревании. Чаще всего продуктами разложения
H2CO3 ↔ CO2 + H2O
Слайд 20Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔
H2SO3 ↔ H2O + SO2↑
Сероводородная кислота в продуктах выделяется в виде газа:
СаS + 2HCl = H2S↑ + CaCl2