- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии: Кислородные соединения углерода
Содержание
- 1. Презентация по химии: Кислородные соединения углерода
- 2. Без углерода не существует ни одного растения или животного…
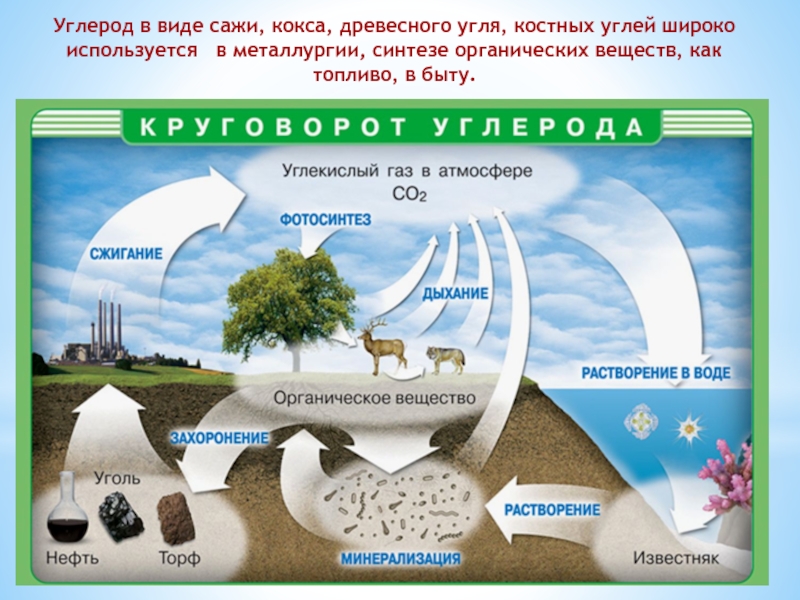
- 3. Углерод в виде сажи, кокса, древесного угля,
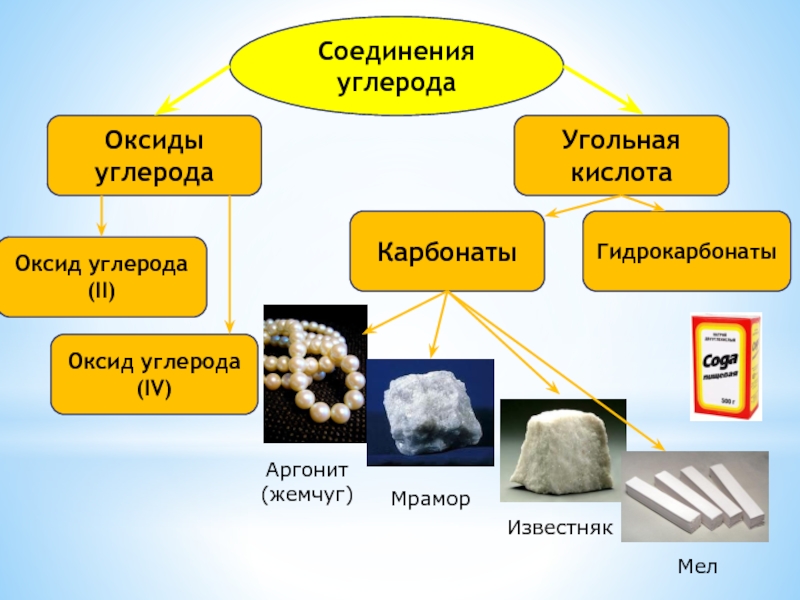
- 4. Соединения углеродаОксиды углеродаУгольная кислотаОксид углерода (II)Оксид углерода (IV)Карбонаты Гидрокарбонаты Аргонит(жемчуг)Мрамор Известняк Мел
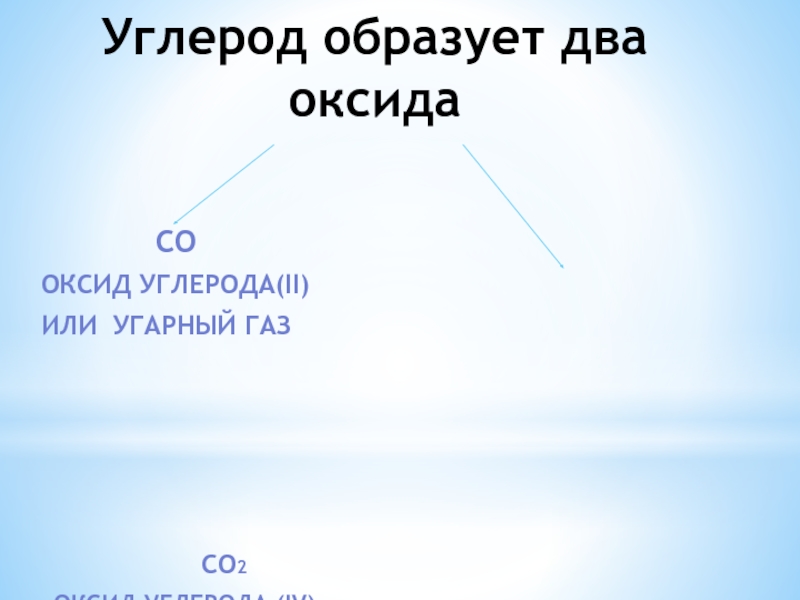
- 5. Углерод образует два оксида
- 6. Оксид углерода (II)иначе угарный газ Оксид углерода
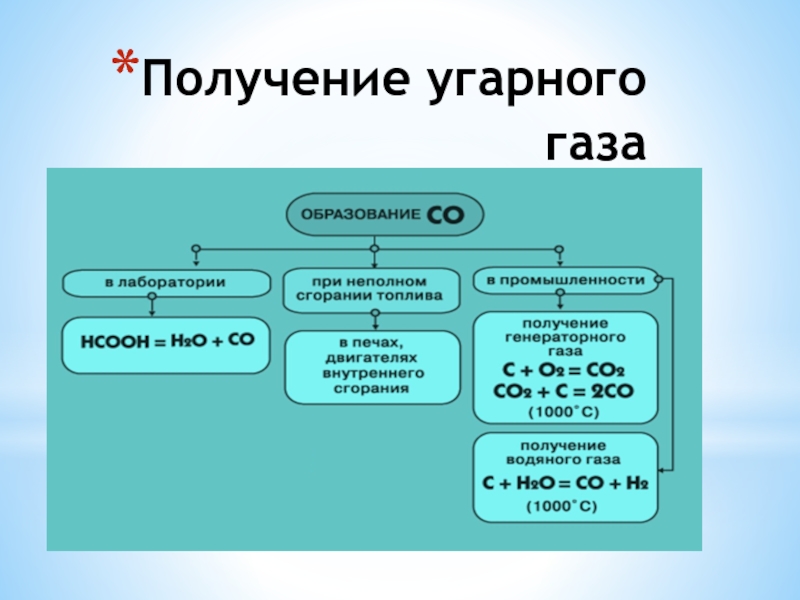
- 7. Получение угарного газа
- 8. Физические свойства бесцветный газ, не имеющий запаха,
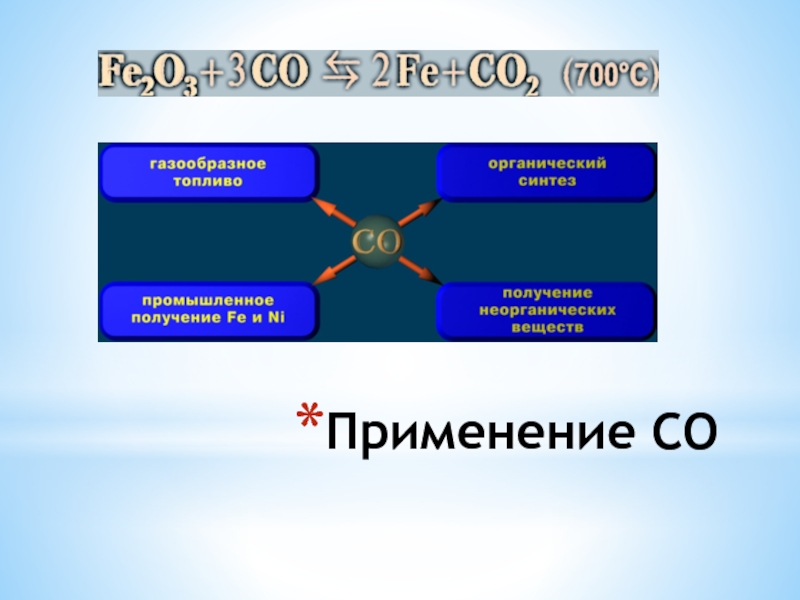
- 9. Применение CO
- 10. Применяется оксид углерода (II) при производстве чугуна и метанола
- 11. Оксид углерода (IV) Получение. Образуется при горении
- 12. * Физические свойства- бесцветный газ, примерно в
- 13. Химические свойстваХимические свойства. Оксид углерода (IV) —
- 14. Слайд 14
- 15. Фотосинтез
- 16. Угольная кислота – соединение крайне непрочное и распадается на CO2 и H2O уже в момент образования:
- 17. Угольная кислота Н₂С0₃ существует только в растворе,
- 18. Соли угольной кислотыКарбонаты( CaCO3, Na2CO3)Гидрокарбонаты(Ca(HCO3)2, NaHCO3)
- 19. Отношение карбонатов к воде и температуре.
- 20. Отношение карбонатов к кислотам. Качественной реакцией на
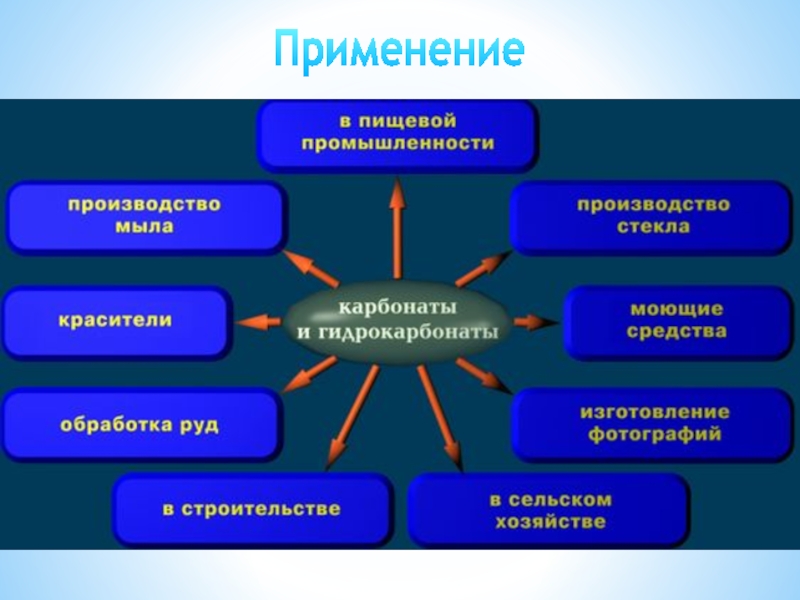
- 21. Применение. Из солей угольной кислоты наиболее широко
- 22. Применение
- 23. На земле живут три брата Из семейства
- 24. Всем известен Известняк, Потому и назван так. Знаменит своим трудом, Строит он за домом дом.
- 25. И способен, и умел Младший мягкий братец Мел. Как рисует, посмотри, Этот СаСО3
- 26. Слайд 26
Слайд 3Углерод в виде сажи, кокса, древесного угля, костных углей широко используется
Слайд 4Соединения углерода
Оксиды углерода
Угольная кислота
Оксид углерода (II)
Оксид углерода (IV)
Карбонаты
Гидрокарбонаты
Аргонит
(жемчуг)
Мрамор
Известняк
Мел
Слайд 5Углерод образует два оксида
оксид углерода(II)
или угарный газ
CO2
оксид углерода (IV)
или углекислый газ
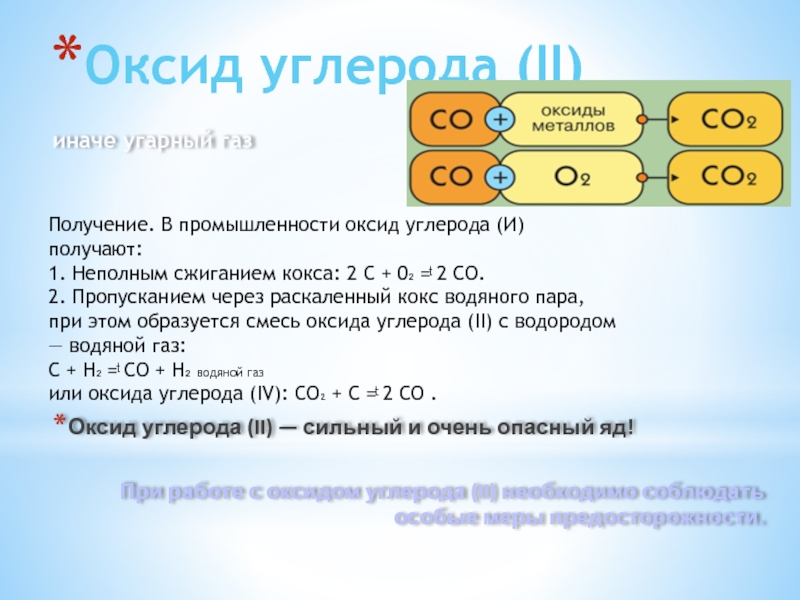
Слайд 6Оксид углерода (II)
иначе угарный газ
Оксид углерода (II) — сильный и
При работе с оксидом углерода (II) необходимо соблюдать особые меры предосторожности.
Получение. В промышленности оксид углерода (И) получают:
1. Неполным сжиганием кокса: 2 С + 0₂ =ͭ 2 СО.
2. Пропусканием через раскаленный кокс водяного пара, при этом образуется смесь оксида углерода (II) с водородом — водяной газ:
С + Н₂ =ͭ СО + Н₂ водяной газ
или оксида углерода (IV): СO₂ + С =ͭ 2 СО .
Слайд 8Физические свойства
бесцветный газ, не имеющий запаха,
плохо растворим в воде,
Химические свойства
несолеобразующий оксид
Молекулы СО очень прочны, поскольку связь между атомами углерода и кислорода в них тройная.
Для оксида углерода (II) характерны восстановительные свойства. Поскольку для углерода наиболее характерна (устойчива) степень окисления +4, оксид углерода (II) при нагревании является активным восстановителем. В кислороде и на воздухе он горит голубоватым пламенем, выделяя много тепла:
2 С²O +O ₂ =ͭ 2С⁴ O₂ˉ² + Q
Также он восстанавливает металлы из оксидов:
CuO + CO =ͭ Cu + CO₂
Горение угарного газа
Слайд 11Оксид углерода (IV)
Получение. Образуется при горении угля, угарного газа;
в промышленности
СаСO₃ ↔СаО + С0₂↑;
в лаборатории при действии кислот на мел или мрамор:
СаСO₃ + 2 НСl = СаСl₂ + Н₂O + СO₂↑;
в природе при медленном окислении в биохимических процессах (дыхание, гниение, брожение). Растворение оксида углерода (IV) – обратимый процесс: H₂O + CO₂ ↔ H₂CO₃ Для углекислого газа не характерны ни окислительные, ни восстановительные свойства, хотя некоторые наиболее активные металлы горят в оксиде: CO₂ + 2Mg = 2MgO + С
или углекислый газ,
Слайд 12* Физические свойства
- бесцветный газ, примерно в 1,5 раза тяжелее воздуха,
в воде достаточно хорошо растворим (газированная вода — это раствор С0₂ в воде).
При обычной температуре и высоком давлении оксид углерода (IV) сжижается.
При его испарении поглощается так много теплоты, что часть оксида углерода (IV) превращается в снегообразную массу — «сухой лед». Последний применяют для хранения скоропортящихся продуктов, мороженого.
В твердом состоянии оксид углерода (IV) имеет молекулярную кристаллическую решетку.
- Оксид углерода (IV) не горит и не поддерживает горение. Горящая лучинка гаснет, если ее ввести в цилиндр с углекислым газом. Поэтому его используют для тушения пожаров.
Слайд 13Химические свойства
Химические свойства. Оксид углерода (IV) — типичный кислотный оксид, взаимодействует
2 NaOH + С02 = Na2C03 + Н20; СаО + С02 =ͭ СаС03 .
При пропускании углекислого газа через раствор гидроксида кальция (известковую воду) наблюдается помутнение в результате образования СаС03:
Са(ОН)2 + С02 = СаС03 ↓ + Н20 .
Эта реакция является качественной —
на оксид углерода (IV).
При растворении оксида углерода (IV) в воде образуется угольная кислота:
С02 + Н20 ↔Н2С03 .
При высоких температурах оксид углерода (IV) проявляет
свойства окислителя → взаимодействует с углем и
активными металлами:
С⁴О₂+С° =ͭ 2С²O, 2 Mg° + С⁴O₂ =ͭ 2 Mg+20 + С0.
Слайд 16Угольная кислота – соединение крайне непрочное и распадается на CO2 и
Слайд 17Угольная кислота Н₂С0₃ существует только в растворе, даже при слабом
Слайд 20Отношение карбонатов к кислотам.
Качественной реакцией на карбонаты и гидрокарбонаты является
CO₃²- + 2 Н+ = Н20 + С02 ↑, НСОз ̄+ H+ = Н20 + CO2 ↑
При пропускании образовавшегося С02 через известковую воду выпадает осадок СаС03 (раствор мутнеет):
С02 + Са2+ + 2 ОН- = СаС03 ↓ + Н20
При избытке С02 помутнение исчезает в результате образования Са(НС03)2:
СаС03 + Н20 + С02 = Са2+ + 2 НСО₃̄