- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Кислород
Содержание
- 1. Презентация по химии Кислород
- 2. Слайд 2
- 3. Слайд 3
- 4. Элемент № 8 OXYGENIUM КИСЛОРОД
- 5. Oxygenium C лат. оxygenium – “ рождающий
- 6. Английский ученый.В 1774 году разложениемoксида ртути (
- 7. .Шведский ученый.В 1771 году провел опыты по
- 8. . 1743 - 1794С целью
- 9. Слайд 9
- 10. Кислород занимает 1
- 11. В земной коре – 49 %(атмосфера, литосфера,
- 12. В 1774 г. А. Лавуазье доказал,
- 13. .Выдыхаемый человеком воздух содержит ( в
- 14. .Отличается от лесного воздуха наличием выбросов:
- 15. .Химический знак – О
- 16. Способы собирания и обнаружения кислорода а –
- 17. .2 KMnO4 = K2MnO4 + MnO2 +
- 18. Кислород получают из воздуха
- 19. . Условия, способствуюшие
- 20. Кислород входит в состав воды, которая составляет
- 21. Кислород на
- 22. .
- 23. Разработчик: Тарантул Антонина Павловна МБОУ СОШ №7 с УИОП Г.Железнодорожный
Слайд 2
1. Элемент № 8
2. Oxygenium - 2. Oxygenium - Кислород
3. Джозеф Пристли
4. Карл Вильгельм Шееле
5. 5. Антуан Лоран Лавуазье
6. 6. Корнелиус Дреббел
7. Распространение 7. Распространение 7. Распространение элементов 7. Распространение элементов 7. Распространение элементов в 7. Распространение элементов в 7. Распространение элементов в земной коре
8. Нахождение кислорода в природе
9. Состав воздуха
10. Выдыхаемый воздух
11. Городской воздух
12. Общая характеристика элемента
13. Способы 13. Способы 13. Способы собирания газа 13. Способы собирания газа, 13. Способы собирания газа, обнаружение
14. Получение 14. Получение 14. Получение кислорода в 14. Получение кислорода в 14. Получение кислорода в лаборатории из перманганата калия
(продолжение следует – см. следующий слайд)
СОДЕРЖАНИЕ
Слайд 3
( продолжение )
15. Получение 15. Получение 15. Получение кислорода в 15. Получение кислорода в 15. Получение кислорода в промышленности
16. Условия 16. Условия, 16. Условия, способствующие возникновению и прекращению
огня
17. Кислород – элемент жизни
18. Самая важная функция кислорода на Земле
19. Применение кислорода
20. Автор работы
Слайд 5Oxygenium
C лат. оxygenium – “ рождающий кислоту”
С греч. oxygenes
Название кислороду Oxygenium
дал А. Лавуазье
Слайд 6
Английский ученый.
В 1774 году разложением
oксида ртути ( II )
получил кислород
и
изучил
2HgO = 2Hg + O2↑
1733 - 1804
ДЖОЗЕФ ПРИСТЛИ
Слайд 7.
Шведский ученый.
В 1771 году провел опыты
по разложению
оксида ртути (
изучил свойства
образующегося газа.
Однако результаты
его исследований
были опубликованы
лишь в 1777 году.
1742 - 1786
КАРЛ ВИЛЬГЕЛЬМ ШЕЕЛЕ
Слайд 8.
1743 - 1794
С целью проверки опытов
Шееле и
в 1774 году получил кислород,
установил его природу и изучил
его способность соединяться
с фосфором и серой при горении
и металлами при обжиге.
Изучил состав атмосферного воздуха.
Создал кислородную теорию горения.
Совместно с Ж. Менье установил
сложный состав воды и получил
воду из кислорода и водорода.
2H2 + O2 = 2H2O
Лавуазье показал, что процесс дыхания
подобен процессу горения.
АНТУАН ЛОРАН ЛАВУАЗЬЕ
Слайд 9
КОРНЕЛИУС
Голландский алхимик и технолог.
Получил кислород примерно за 150 лет
до Пристли и Шееле при нагревании нитрата калия:
2КNO3 = 2KNO2 + O2 ↑
Его открытие было засекречено, т.к. использование полученного газа предполагалось для дыхания людей на подводных лодках
1572 - 1633
Слайд 10
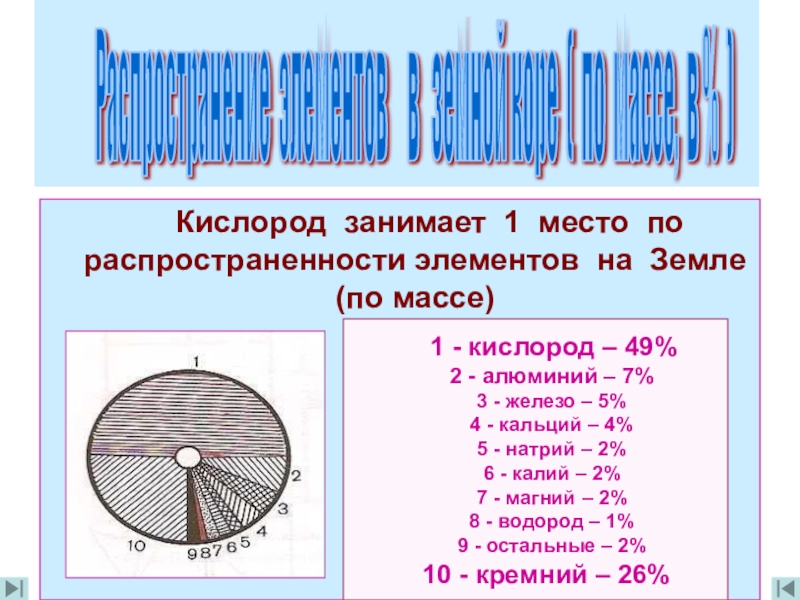
Кислород занимает 1 место по распространенности элементов
Распространение элементов в земной коре ( по массе, в % )
1 - кислород – 49%
2 - алюминий – 7%
3 - железо – 5%
4 - кальций – 4%
5 - натрий – 2%
6 - калий – 2%
7 - магний – 2%
8 - водород – 1%
9 - остальные – 2%
10 - кремний – 26%
Слайд 11
В земной коре – 49 %
(атмосфера, литосфера, гидросфера)
В воздухе –
В воде
(в чистой воде – 88,8 %, в морской воде – 85,8 % )
В песке , многих горных породах и минералах
В составе органических соединений:
белков, жиров, углеводов и др.
В организме человека – 62 %
Нахождение кислорода в природе ( по масее, в % )
Слайд 12 В 1774 г. А. Лавуазье доказал, что воздух – это
СОСТАВ ВОЗДУХА
Сжигание фосфора
под колоколом:
а – горение фосфора;
б – уровень воды
поднялся на 1 / 5 объема
Примечание
К другим газам (1%) относятся:
углекислый газ (0,03%);
инертные газы
( в основном аргон - 0,93% );
водяные пары
Кислород - 21%
Азот - 78%
Другие газы -1%
( по объему, в % )
Слайд 13.
Выдыхаемый человеком воздух
содержит ( в %, по объему)
Выдыхаемый воздух
1 – Кислород 16%
2 – Углекислый газ 4%
3 – Остальное: азот,
водяные пары и пр.
Слайд 14.
Отличается от лесного воздуха наличием выбросов:
от автотранспорта ( в Москве - 90% всех загрязнений)
от котельных установок
от промышленных предприятий
Автомашины выбрасывают в атмосферу:
углекислый газ СО2, сернистый газ SO2, оксиды азота NO и NO2 , угарный газ СО, формальдегид НСОН, а также сажу
Металлургические предприятия выбрасывают в воздух:
сернистый газ, угарный газ, формальдегид, циановодород НСN
Алюминиевые заводы
фтороводород НF
Целлюлозно – бумажныые комбинаты
сероводород, хлор, фенол C6H5OH и формальдегид
,
Городской воздух
Слайд 15.
Химический знак – О
Относительная атомная масса: Ar = 16
Заряд ядра: ( +8)
Электронная конфигурация атома: 1s22s2 2p4
Типичный неметалл. Сильный окислитель ( по электроотрицательности уступает лишь фтору )
Валентные возможности: в соединениях обычно 2-х валентен, реже – 3-х, (4-х) валентен
Общая характеристика элемента
Слайд 16
Способы собирания и обнаружения кислорода
а – вытеснением воды ( над
Слайд 17.
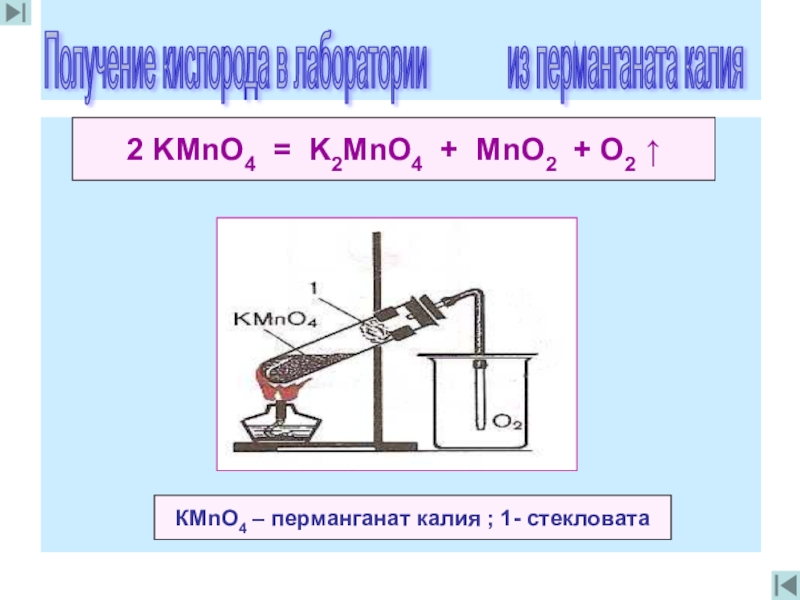
2 KMnO4 = K2MnO4 + MnO2 + O2 ↑
КМnO4 – перманганат
Получение кислорода в лаборатории из перманганата калия
Слайд 18 Кислород получают из воздуха
газовой ректификацией
Воздух охлаждают
Далее жидкий воздух подвергают перегонке
Жидкий азот испаряется при – 196 ОС
( t кип. жидкого азота)
Жидкий кислород испаряется при – 183 ОС
( t кип. жидкого кислорода)
Газообразный кислород хранят в стальных баллонах, окрашенных в голубой цвет, под давлением 1 - 1,5 МПА
Получение в промышленности
Слайд 20
Кислород входит в состав воды, которая составляет большую часть массы живых
Кислород входит в состав биологически важных молекул, образующих живую материю
(белки, углеводы, жиры, гормоны, ферменты и др. )
Кислород в виде простого вещества О2 необходим как окислитель для протекания реакций, дающих клеткам необходимую для жизнедеятельности энергию
Кислород - элемент жизни
Слайд 21
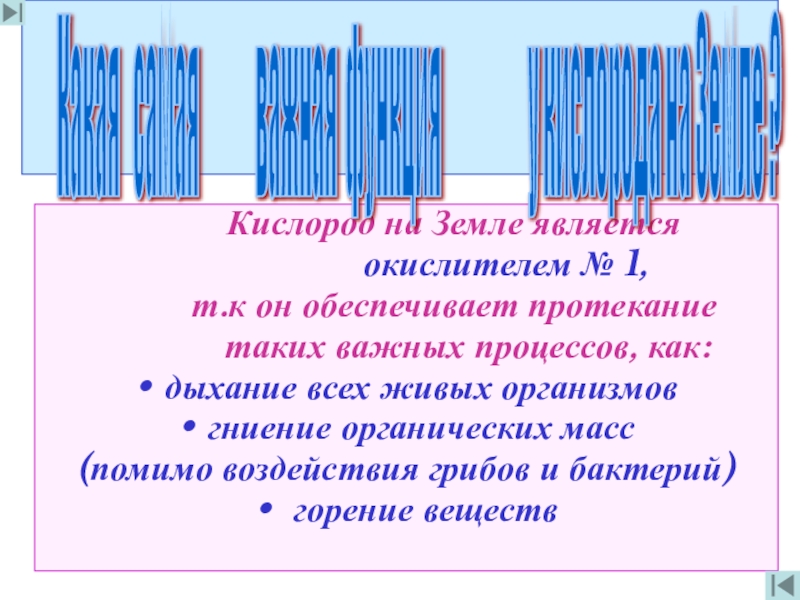
Кислород на Земле является
т.к он обеспечивает протекание
таких важных процессов, как:
дыхание всех живых организмов
гниение органических масс
(помимо воздействия грибов и бактерий)
горение веществ
Какая cамая важная функция у кислорода на Земле ?
Слайд 22.
В чистом виде:
В металлургии – при получении чугуна, стали, цветных металлов ( для интенсификации окислительных процессов)
Во многих химических производствах
Как жидкий окислитель для ракет
При резке и сварке металлов и сплавов
В медицине - для приготовления лечебных водных и воздушных ванн, лечебных коктейлей
В медицине - в кислородных подушках
В чистом виде и в составе смесей:
На космических кораблях, подводных лодках в подводном плавании, на больших высотах
В составе воздуха:
Для сжигания топлива (в двигателях автомобилей, тепловозов, теплоходов; на тепловых электростанциях, на многих производствах и др.)
Применение кислорода