- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии - КИСЛОРОД
Содержание
- 1. Презентация по химии - КИСЛОРОД
- 2. Без кислорода - беда: ведь он нужен
- 3. КИСЛОРОДО2
- 4. Характеристика элемента – кислород: В ПСХЭ
- 5. Физические свойства кислородаГаз (н.у.) без вкуса, цвета
- 6. Нахождение в природеВ свободном состоянии – в
- 7. Получение кислородаВесь свободный кислород атмосферы — является побочным
- 8. Химические свойства кислородаКислород - окислительС простыми веществами
- 9. Применение кислородаhttp://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/primenenie-kisloroda
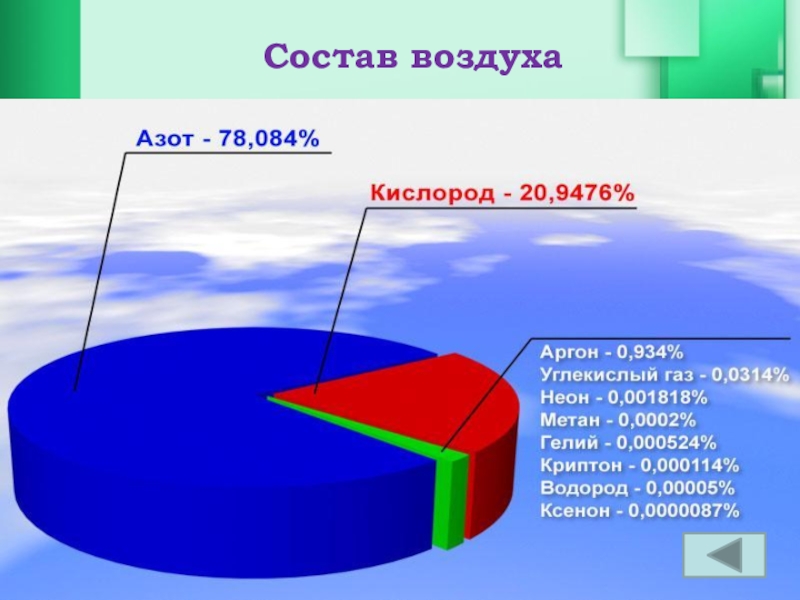
- 10. Состав воздуха
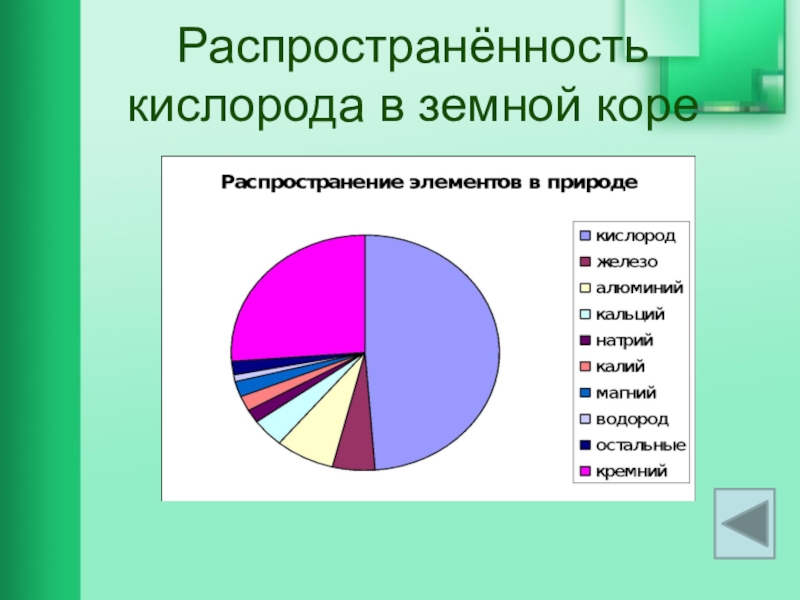
- 11. Распространённость кислорода в земной коре
- 12. Жидкий кислород
- 13. Важнейшие соединения - оксидыН2О - водаУглекислый газ CO2- оксид углерода (IV),Негашеная известь –CaO.Оксид кремния SiO2-
- 14. Решить задачу:Рассчитайте объём кислорода, который образуетсяпри взаимодействии
Без кислорода - беда: ведь он нужен для дыхания и горения, без него нет ни жизни, ни тепла. Это самое главное вещество Земли.
Слайд 2Без кислорода - беда: ведь он нужен для дыхания
и горения, без него нет
ни жизни, ни тепла.
Это самое главное вещество Земли.
Это самое главное вещество Земли.
Слайд 4
Характеристика элемента – кислород:
В ПСХЭ находится в во 2 периоде
VI
группе главной подгруппе;
Порядковый № 8, заряд ядра +8 (8р,8n)
Распределение электронов 2е 6е;
Характерная степень окисления +2.
Типичный окислитель.
Ar(O)=16 Mr(O2) = 32
Химический знак – О;
Химическая формула молекулы О2
Порядковый № 8, заряд ядра +8 (8р,8n)
Распределение электронов 2е 6е;
Характерная степень окисления +2.
Типичный окислитель.
Ar(O)=16 Mr(O2) = 32
Химический знак – О;
Химическая формула молекулы О2
Слайд 5Физические свойства кислорода
Газ (н.у.) без вкуса, цвета и запаха
Тяжелее воздуха
Малорастворим в
воде
Тсжиж= - 183 С; Тзам = - 219 С
(голубой) (синий)
Тсжиж= - 183 С; Тзам = - 219 С
(голубой) (синий)
Слайд 6Нахождение в природе
В свободном состоянии – в воздухе
В связанном состоянии:
в земной
коре
важнейшие соединения
ВЫВОД: кислород – самый распространённый элемент на ЗЕМЛЕ
важнейшие соединения
ВЫВОД: кислород – самый распространённый элемент на ЗЕМЛЕ
Слайд 7Получение кислорода
Весь свободный кислород атмосферы — является побочным продуктом фотосинтеза.
6CO2+6H2O=C6H12O6+6O2↑(задача)
В лаборатории разложение
сложных веществ при нагревании:
2KMnO4 = K2MnO4 + MnO2 + O2↑
MnO2
2Н2О2 → 2Н2О+О2 ↑
В промышленности:
эл.ток
2Н2О → 2Н2 ↑ +О2 ↑ и из воздуха
2KMnO4 = K2MnO4 + MnO2 + O2↑
MnO2
2Н2О2 → 2Н2О+О2 ↑
В промышленности:
эл.ток
2Н2О → 2Н2 ↑ +О2 ↑ и из воздуха
Слайд 8Химические свойства кислорода
Кислород - окислитель
С простыми веществами c неMe и Ме:
http://files.school-collection.edu.ru/dlrstore/8d80b4a9-aa8f-42a9-bafd-4e66d0d46c86/54.swf
C сложными веществами:
2SO2 +O2 → 2SO3 ;
СН4 +2O2 → СО2 + 2Н2O
Вывод: реакции с участием кислорода: ОВР(окисление), экзотермические (искл. c N2)-
происходит горение
C сложными веществами:
2SO2 +O2 → 2SO3 ;
СН4 +2O2 → СО2 + 2Н2O
Вывод: реакции с участием кислорода: ОВР(окисление), экзотермические (искл. c N2)-
происходит горение
Слайд 9Применение кислорода
http://interneturok.ru/ru/school/chemistry/8-klass/bvewestva-i-ih-prevraweniyab/primenenie-kisloroda
Слайд 13Важнейшие соединения - оксиды
Н2О - вода
Углекислый газ CO2- оксид углерода (IV),
Негашеная
известь –CaO.
Оксид кремния SiO2-
Слайд 14Решить задачу:
Рассчитайте объём кислорода, который образуется
при взаимодействии 1,12 л углекислого газа
с водой.
РЕШЕНИЕ:
6CO2+6H2O=C6H12O6+6O2↑
n(CO2) = 1,12 л/22,4л/моль = 0,05 моль
По уравнению реакции n(CO2) = n(O2) = 0,05 моль
V(O2)= 0,05 моль∙ 22,4л/моль = 1,12 л
РЕШЕНИЕ:
6CO2+6H2O=C6H12O6+6O2↑
n(CO2) = 1,12 л/22,4л/моль = 0,05 моль
По уравнению реакции n(CO2) = n(O2) = 0,05 моль
V(O2)= 0,05 моль∙ 22,4л/моль = 1,12 л