- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Кальций и магний
Содержание
- 1. Презентация по химии Кальций и магний
- 2. Строение атомов Особенностью строение атомов элементов 2
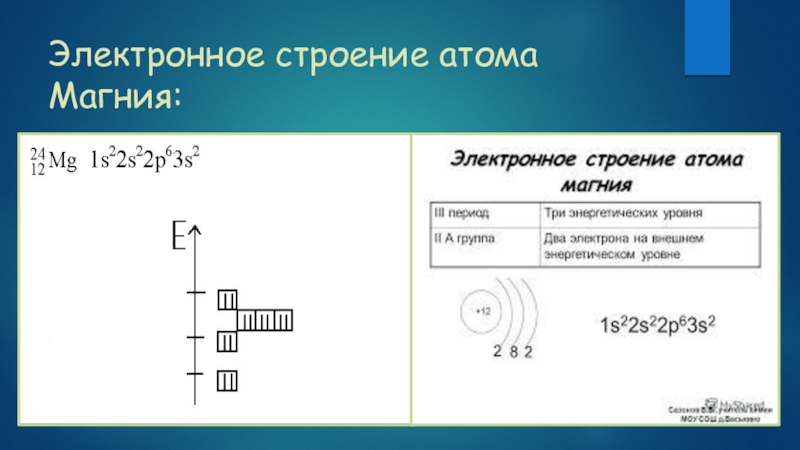
- 3. Электронное строение атома Магния:
- 4. Электронное строение атома Кальция||||||||||||||||||||
- 5. Нахождение в природе металлов 2A группы.Все щёлочноземельные
- 6. Гипс — гидратированный сульфат кальция, один из
- 7. Магнезит — распространенный минерал из группы кальцита; карбонат магния. Широко используется во многих отраслях промышленности.
- 8. Апати́т — минерал класса фосфатов, как правило, бледно-зеленоватого, голубого,
- 9. Получение. MgОбычный промышленный метод получения металлического магния —
- 10. Магний является одним из важнейших компонентов хлорофилла
- 11. Получение. CaСвободный металлический кальций получают электролизом рас-плава, состоящего из
- 12. Кальций является пятым наиболее распространенным минералом на
- 13. Физические свойстваМагнийМагний — металл серебристо-белого цвета, обладает металлическим
- 14. Химические свойства CaКальций - типичный щелочноземельный металл.
- 15. Ca Кальций активно реагирует с водой, но без воспламенения:Ca + 2H2O = Ca(OH) 2 + H2
- 16. CaС активными неметаллами (кислородом, хлором, бромом, иодом) кальций реагирует при обычных условиях:2Ca + O2 = 2CaOCa + Br2 = CaBr2
- 17. CaС менее активными неметаллами (водородом, бором, углеродом,
- 18. Ca Большинство из соединений кальция с неметаллами легко
- 19. Химические свойства MgВ химическом отношении Магний -
- 20. MgПри нагревании на воздухе магний сгорает с
- 21. MgМагний может гореть даже в углекислом газе:2Mg
- 22. Применение МагнияИспользуется для получения
- 23. Применение МагнияСплавы на основе магния являются важным
- 24. Применение Кальция Главное применение металлического кальция — это
Слайд 2Строение атомов
Особенностью строение атомов элементов 2 А группы является то,
Атомы щелочно-земельных металлов и их соли окрашивают пламя в разные цвета. Например, Ca в кирпично-красный цвет. Таким образом, используя это свойство химических элементов также можно распознавать соли щелечно-земельных металлов.
Слайд 5Нахождение в природе металлов 2A группы.
Все щёлочноземельные металлы имеются (в разных
Mg
MgCO3 – магнезит
KCl • MgSO4 • 3H2O – каинит
Ca
CaCO3 – кальцит (известняк, мрамор и др.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2H2O – гипс
Слайд 6Гипс — гидратированный сульфат кальция, один из самых распространенных минералов; термин
Слайд 7Магнезит — распространенный минерал из группы кальцита; карбонат магния. Широко используется
Слайд 8Апати́т — минерал класса фосфатов, как правило, бледно-зеленоватого, голубого, желто-зеленого или розового цвета
Слайд 9Получение. Mg
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит),
Другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
MgO + C = Mg + CO
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Слайд 10Магний является одним из важнейших компонентов хлорофилла растений и встречается на
При физических нагрузках потребность человеческого организма в магнии существенно увеличивается, например, у спортсменов во время интенсивных и длительных тренировок, в ходе ответственных спортивных соревнований, при возникновении стрессовых ситуаций. Потеря магния человеческим организмом в подобных ситуациях сопоставима со степенью эмоциональной или физической нагрузки.
При сгорании магния начинает выделяться огромное количество тепла и ультрафиолетовых лучей: четыре грамма данного «топлива» хватает для того, чтобы довести до кипения стакан с ледяной водой.
Слайд 11Получение. Ca
Свободный металлический кальций получают электролизом рас-плава, состоящего из CaCl2 (75-80 %) и KCl или
4 CaO + 2Al = CaAl2 O4 + 3Ca
- Разработан также способ получения кальция термической диссоциацией карбида кальция CaC2
Слайд 12Кальций является пятым наиболее распространенным минералом на планете
В организме взрослого человека
«Жёсткость» воды — это ряд свойств, которые придают воде растворенные в ней соли кальция и магния.
Изотоп 48Ca является очень редким очень дорогим; как было недавно обнаружено, испытывает двойной бета-распад с периодом полураспада 5,3x1019 лет. Играет ключевую роль в экспериментах по синезу супертяжелых элементов (Z = 110,112) с помощью реакции 232Th, 238U +48Ca
Слайд 13Физические свойства
Магний
Магний — металл серебристо-белого цвета, обладает металлическим блеском;
При обычных условиях поверхность
температура плавления металла tпл = 650 °C, температура кипения tкип = 1090 °C
Магний высокой чистоты пластичен, хорошо прессуется, прокатывается и поддаётся обработке резанием.
Кальций
Кальций — легкий серебристо-белый и довольно твердый металл.
Температура плавления и кипения выше, чем у щелочных металлов ( 842°C)
При постепенном повышении давления начинает проявлять свойства полупроводника, но не становится полупроводником в полном смысле этого слова (металлом уже тоже не является). При дальнейшем повышении давления возвращается в металлическое состояние и начинает проявлять сверхпроводящие свойства (температура сверхпроводимости в шесть раз выше, чем у ртути, и намного превосходит по проводимости все остальные элементы).
Слайд 14Химические свойства Ca
Кальций - типичный щелочноземельный металл. Химическая активность кальция высока,
Слайд 16Ca
С активными неметаллами (кислородом, хлором, бромом, иодом) кальций реагирует при обычных условиях:
2Ca + O2 = 2CaO
Ca
Слайд 17Ca
С менее активными неметаллами (водородом, бором, углеродом,
Ca + H2 = CaH2
3Ca + 2B = Ca3 В2
3Ca + N2 = Ca3 N2
Ca + 2C = CaC2
Слайд 18 Ca
Большинство из соединений кальция с неметаллами легко разлагается водой:
CaH2 + 2H2O
Слайд 19Химические свойства Mg
В химическом отношении Магний - весьма активный металл.
Раскаленный Магний
Mg + H2O = Mg0 + H2 + 75 kcal
Слайд 20Mg
При нагревании на воздухе магний сгорает с образованием оксида и небольшого
2Mg + O2 = 2MgO
3Mg + N2 = Mg3 N2
Слайд 21Mg
Магний может гореть даже в углекислом газе:
2Mg + CO2 = 2MgO
Щелочи на магний не действуют, в кислотах он растворяется с бурным выделением водорода:
Mg + 2HCl = MgCl2 + H2
Магний со взрывом реагирует с сильными окислителями
Слайд 22 Применение Магния
Используется для получения лёгких и сверхлёгких сплавов
Военное дело :
Свойство магния гореть белым ослепительным пламенем широко используется в военной технике для изготовления осветительных и сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб. В смеси с соответствующими окислителями он также является основным компонентом заряда светошумовых боеприпасов.
Слайд 23Применение Магния
Сплавы на основе магния являются важным конструкционным материалом в авиационной
Химические источники тока на основе магния отличаются очень высокими значениями удельных энергетических характеристик и высоким разрядным напряжением.
Огнеупорные материалы (Фторид магния MgF2 — в виде синтетических монокристаллов применяется в оптике (линзы, призмы); Оксид магния MgO применяется в качестве огнеупорного материала для производства тиглей)
Аккумуляторы : Магниево-серные батареи
Слайд 24Применение Кальция
Главное применение металлического кальция — это использование его как восстановителя
Сплавы кальция со свинцом находят применение в аккумуляторных батареях и подшипниковых сплавах.
Чистый металлический кальций широко применяется в металлотермии при получении редкоземельных элементов
Изотоп 48Ca — один из эффективных и употребительных материалов для производства сверхтяжёлых элементов и открытия новых элементов таблицы Менделеева.