- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Характеристика серы
Содержание
- 1. Презентация по химии Характеристика серы
- 2. Нахождение серы в природеСера является на 16-м
- 3. Сера также встречается в виде сульфатов – солей серной кислоты – мирабилит.
- 4. Слайд 4
- 5. Сера в природеСера входит в состав белков.
- 6. 1.Серная кислота в чистом виде (формула H2SO4),
- 7. 6.В зависимости от концентрации серная кислота по-разному
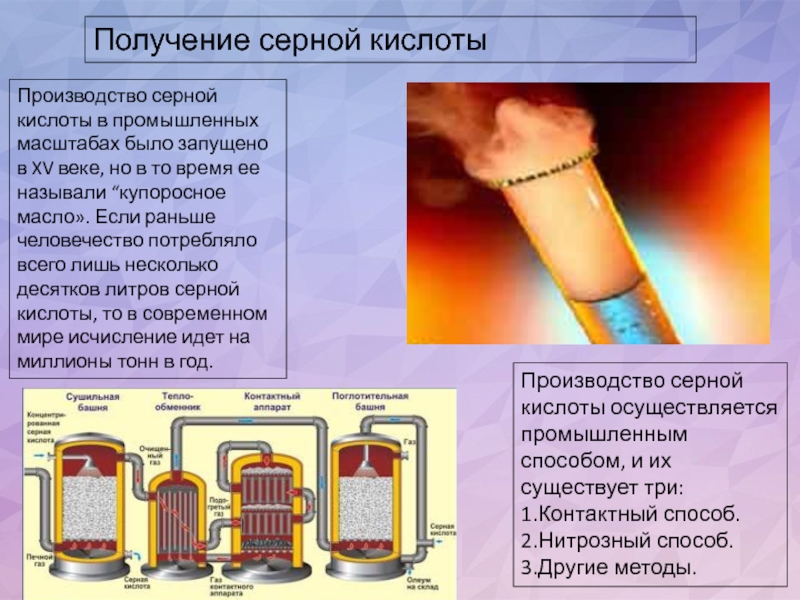
- 8. Получение серной кислотыПроизводство серной кислоты в промышленных
- 9. Кислотные дожди: аномальные дождиВ норме водородный показатель
- 10. В составе нормальных осадков, помимо воды, присутствует
- 11. 1.Природным источником загрязнения атмосферы соединениями серы являются вулканы в
- 12. Основные антропогенные факторы, вызывающие образование кислотных дождей:выбросы
Слайд 1сера
Выполнили работу ученицы 9 класса «А» Кацендорн Дарья, Рубан Валерия, Гугина
Слайд 2Нахождение серы в природе
Сера является на 16-м месте по распространенности в
Слайд 5Сера в природе
Сера входит в состав белков. Особенно много серы в
Слайд 61.Серная кислота в чистом виде (формула H2SO4), при концентрации 100% представляет
2.H2SO4 – это сильная кислота.
3.Серная кислота называется моногидратом – в ней на 1 моль SO3 приходится 1 моль Н2О (воды). Из-за ее внушительных гигроскопических свойств ее используют для извлечения влаги из газов.
4.Температура кипения – 330 °С. При этом происходит разложение кислоты на SO3 и воду. Плотность – 1,84. Температура плавления – 10,3 °С.
5.Концентрированная серная кислота представляет собой мощный окислитель. Чтобы запустить окислительно-восстановительную реакцию кислоту требуется нагреть. Итог реакции – SO2. S+2H2SO4=3SO2+2H2O
Основные физические и химические свойства серной кислоты.
Слайд 76.В зависимости от концентрации серная кислота по-разному вступает в реакцию с
7.Серная кислота образует два вида солей: кислые (это гидросульфаты) и средние (сульфаты)
8.H2SO4 вступает в активную реакцию с органическими веществами и неметаллами, причем некоторые из них она способна превратить в уголь.
9.Серный ангидрит отлично растворяется в H2SО4, и при этом образуется олеум – раствор SО3 в серной кислоте. Внешне это выглядит так: дымящаяся серная кислота, выделяющая серный ангидрит.
10.Серная кислота в водных растворах является сильной двухосновной, и при добавлении ее к воде выделяется огромное количество теплоты. Когда готовят разбавленные растворы H2SО4 из концентрированных, необходимо небольшой струйкой добавлять более тяжелую кислоту к воде, а не наоборот. Это делается во избежание вскипания воды и разбрызгивания кислоты.
Слайд 8Получение серной кислоты
Производство серной кислоты в промышленных масштабах было запущено в
Производство серной кислоты осуществляется промышленным способом, и их существует три:
1.Контактный способ.
2.Нитрозный способ.
3.Другие методы.
Слайд 9Кислотные дожди: аномальные дожди
В норме водородный показатель (рН) атмосферных осадков, выпадающих
Другое дело – осадки с повышенной кислотностью. Их образование свидетельствует о высоком уровне загрязнения атмосферы и воды рядом окислов. Они считаются аномальными.
Впервые понятие «кислотные дожди» ввёл шотландский химик Роберт Ангус Смит в 1872 году. Сейчас этим термином принято обозначать любые кислые осадки, будь то туман, снег или град.
Слайд 10В составе нормальных осадков, помимо воды, присутствует угольная кислота. Она является
Причины образования кислотных дождей
Слайд 111.Природным источником загрязнения атмосферы соединениями серы являются вулканы в период активности. Во время
2.Серо- и азотосодержащие вещества попадают в атмосферу при гниении растительных остатков и трупов животных.
3.Факторами естественного загрязнения воздуха азотными соединениями являются молнии и грозовые разряды. На них приходится 8 млн тонн кислотообразующих выбросов в год
Слайд 12Основные антропогенные факторы, вызывающие образование кислотных дождей:
выбросы предприятий металлургии, машиностроения и
выделение метана при выращивании риса;
выхлопы автотранспорта;
использование спреев, содержащих хлороводород;
сжигание органического топлива (мазута, угля, газа, дров);
угольная, газовая и нефтяная добыча;
удобрение почв азотсодержащими препаратами;
утечка фреона из кондиционеров и холодильников.