- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Фосфор и его соединения
Содержание
- 1. Презентация по химии Фосфор и его соединения
- 2. СодержаниеСтроение атома фосфораАллотропные модификации фосфораНахождение в природеХимические
- 3. Строение атома фосфораЭлемент VA группы имеет электронную
- 4. Аллотропные модификации фосфора Белый фосфор обладает молекулярной
- 5. Противоядием при отравлении фосфором служит 2% раствор
- 6. Красный фосфор – порошок со слабо выраженной
- 7. Фиолетовый и черный фосфор также получают из
- 8. Нахождение в природе Фосфор - составная часть растительных
- 9. В природе фосфор находится в связанном виде.
- 10. Химические свойства фосфора В химическом отношении
- 11. Фосфор соединяется со многими простыми веществами –
- 12. 2. С галогенами. С элементами, обладающими большей, чем
- 13. 3. С серой при нагревании. 4P + 6S
- 14. 5. Красный фосфор окисляется водой при температуре
- 15. Получение фосфора Фосфор может быть получен нагреванием смеси
- 16. Фосфин Фосфор в степени окисления -3 образует
- 17. Соли фосфония в водных растворах неустойчивы: PH4+ +
- 18. Оксид фосфора (V) Оксид фосфора(V) P2O5 (или
- 19. или при нагревании ортофосфорную кислоту Н3РО4. P2O5 +
- 20. Ортофосфорная кислотаВ промышленности фосфорную кислоту получают действием
- 21. Химические свойства фосфорной кислоты1.С металлами, стоящими в
- 22. 4.С солями слабых кислот:2H3PO4 + 3Na2CO3 →
- 23. 6.При действии раствора нитрата серебра появляется желтый
- 24. Соли фосфорной кислоты Различают средние соли - фосфаты
- 25. Слайд 25
СодержаниеСтроение атома фосфораАллотропные модификации фосфораНахождение в природеХимические свойства фосфораПолучение фосфораФосфинОксид фосфора (Оксид фосфора (VОксид фосфора (V)Ортофосфорная кислотаСоли фосфорной кислотыИсточники информацииЗагадки
Слайд 2Содержание
Строение атома фосфора
Аллотропные модификации фосфора
Нахождение в природе
Химические свойства фосфора
Получение фосфора
Фосфин
Оксид фосфора
(Оксид фосфора (VОксид фосфора (V)
Ортофосфорная кислота
Соли фосфорной кислоты
Источники информации
Загадки
Ортофосфорная кислота
Соли фосфорной кислоты
Источники информации
Загадки
Слайд 3Строение атома фосфора
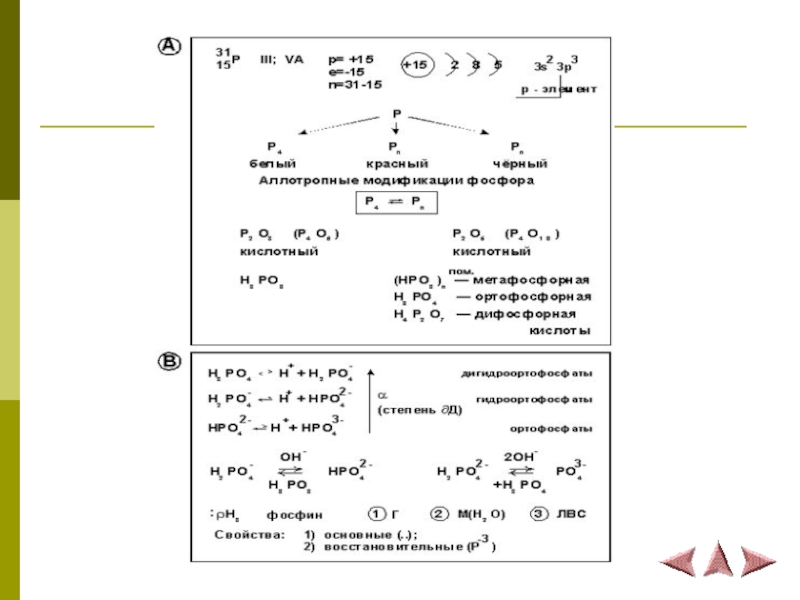
Элемент VA группы имеет электронную формулу 1s22s22p63s23p3.
Фосфор –
неметалл.
Наиболее характерные степени окисления: +5, +3, 0, -3.
Оксиды Э2О5 и Э2О3 имеют кислотные свойства.
Летучее водородное соединение – фосфин PH3.
Наиболее характерные степени окисления: +5, +3, 0, -3.
Оксиды Э2О5 и Э2О3 имеют кислотные свойства.
Летучее водородное соединение – фосфин PH3.
Слайд 4Аллотропные модификации фосфора
Белый фосфор обладает молекулярной
кристаллической решеткой; это
вещество
желтоватого цвета с чесночным запахом. В
парах имеет состав Р4.На воздухе
воспламеняется при 18ºС. При хранении на
свету переходит в красный. В воде
нерастворим, зато хорошо растворим
в сероуглероде, бензоле и других
органических растворителях.
Он весьма ядовит: 0,1 г белого фосфора –
смертельная доза для человека.
желтоватого цвета с чесночным запахом. В
парах имеет состав Р4.На воздухе
воспламеняется при 18ºС. При хранении на
свету переходит в красный. В воде
нерастворим, зато хорошо растворим
в сероуглероде, бензоле и других
органических растворителях.
Он весьма ядовит: 0,1 г белого фосфора –
смертельная доза для человека.
Слайд 5 Противоядием при отравлении фосфором
служит 2% раствор медного купороса,
который следует
давать больному через 5
минут по чайной ложке до появления рвоты.
Горящий фосфор не только причиняет
очень сильные ожоги, но и вызывает
отравление тканей, прилежащих к месту ожога,
вследствие чего заживление идет крайне
медленно. При ожогах фосфором
противоядием служит мокрая повязка,
пропитанная 5% раствором медного купороса.
В связи с тем, что белый фосфор легко
окисляется и воспламеняется, его хранят под
водой.
минут по чайной ложке до появления рвоты.
Горящий фосфор не только причиняет
очень сильные ожоги, но и вызывает
отравление тканей, прилежащих к месту ожога,
вследствие чего заживление идет крайне
медленно. При ожогах фосфором
противоядием служит мокрая повязка,
пропитанная 5% раствором медного купороса.
В связи с тем, что белый фосфор легко
окисляется и воспламеняется, его хранят под
водой.
Слайд 6Красный фосфор – порошок со слабо выраженной кристаллической структурой и поэтому
названный аморфным, темно-красного цвета, имеет атомную решетку, весьма гигроскопичен (легко поглощает воду), но в воде нерастворим; нерастворим он и в сероуглероде.
Красный фосфор получается при длительном нагревании белого фосфора без доступа воздуха при 450ºС. В отличие от белого – не ядовит, запаха не имеет, воспламеняется при 250 - 300ºС.
Красный фосфор получается при длительном нагревании белого фосфора без доступа воздуха при 450ºС. В отличие от белого – не ядовит, запаха не имеет, воспламеняется при 250 - 300ºС.
Слайд 7Фиолетовый и черный фосфор также получают из белого при высоких давлении
и температуре. Черный фосфор обладает металлическим блеском, проводит электричество и тепло. Следовательно, у фосфора в незначительной степени проявляются металлические свойства
Слайд 8Нахождение в природе
Фосфор - составная часть растительных и
животных белков. У
растений фосфор
сосредоточен в семенах, у животных - в
нервной ткани, мышцах, скелете.
Организм человека содержит около 1,5 кг
фосфора: 1,4 кг – в костях, 130 г – в мышцах и
13 г в нервной ткани.
Содержание фосфора в организме человека
составляет приблизительно 1% от массы тела.
Суточное потребление фосфора человеком –
около 2 г.
сосредоточен в семенах, у животных - в
нервной ткани, мышцах, скелете.
Организм человека содержит около 1,5 кг
фосфора: 1,4 кг – в костях, 130 г – в мышцах и
13 г в нервной ткани.
Содержание фосфора в организме человека
составляет приблизительно 1% от массы тела.
Суточное потребление фосфора человеком –
около 2 г.
Слайд 9В природе фосфор находится в связанном виде. Важнейшие минералы: апатит и
фосфорит Ca3(PO4)2. Известно много разновидностей апатита, из которых наиболее распространен фторапатит 3Ca3(PO4)2· CaF2.
Слайд 10Химические свойства фосфора
В химическом отношении белый фосфор сильно отличается
от красного.
Белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой.
Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240ºС.
При окислении белый фосфор светится в темноте – происходит непосредственное превращение химической энергии в световую.
Белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой.
Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240ºС.
При окислении белый фосфор светится в темноте – происходит непосредственное превращение химической энергии в световую.
Слайд 11 Фосфор соединяется со многими простыми
веществами – кислородом, галогенами, серой и
некоторыми металлами, проявляя
окислительные и восстановительные свойства.
1. С кислородом.
При горении фосфора образуется белый
густой дым. Белый фосфор самовоспламеняется
на воздухе, а красный горит при поджигании.
Фосфор сгорает в кислороде ослепительно
ярким пламенем.
4P + 3O2(недостат) → 2P2O3 (P4O6)
4P + 5O2(избыток) → 2P2O5 (P4O10)
Слайд 122. С галогенами.
С элементами, обладающими большей, чем у
фосфора, электроотрицательностью, фосфор
реагирует очень энергично.
Если в сосуд с хлором внести красный
фосфор, то через несколько секунд он
самовоспламеняется в хлоре. При этом обычно
получается хлорид фосфора (III).
4P + 6Cl2(недостат) → 4PCl3
4P + 10Cl2(избыток) → 4PCl5
Слайд 13 3. С серой при нагревании.
4P + 6S → 2P2S3
4P + 10S → 2P2S5
4. Фосфор окисляет при нагревании почти
все металлы, образуя фосфиды:
2P + 3Ca → Ca3P2
Фосфиды металлов легко гидролизуются
водой.
Ca3P2 + 6H2O → 2PH3 ↑+ 3Ca(OH)2
4. Фосфор окисляет при нагревании почти
все металлы, образуя фосфиды:
2P + 3Ca → Ca3P2
Фосфиды металлов легко гидролизуются
водой.
Ca3P2 + 6H2O → 2PH3 ↑+ 3Ca(OH)2
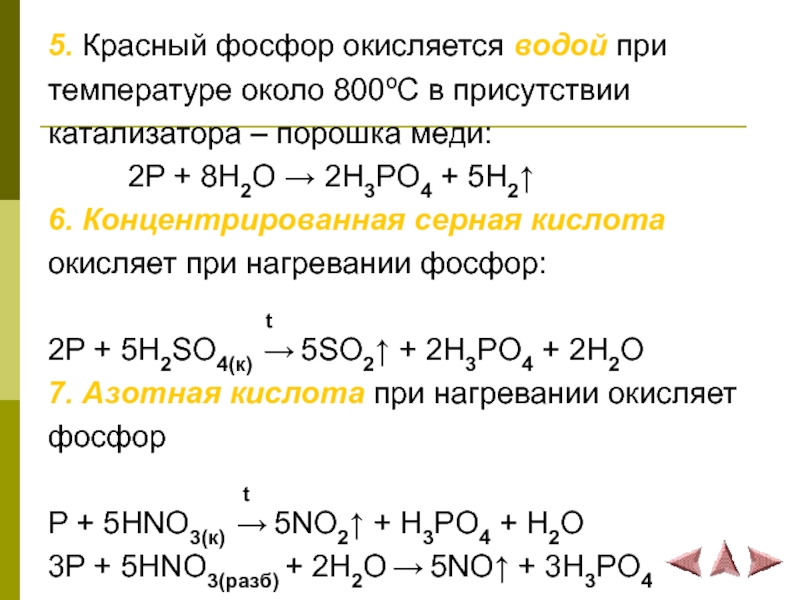
Слайд 145. Красный фосфор окисляется водой при
температуре около 800ºС в присутствии
катализатора – порошка меди:
2P + 8H2O → 2H3PO4 + 5H2↑
6. Концентрированная серная кислота
окисляет при нагревании фосфор:
t
2P + 5H2SO4(к) → 5SO2↑ + 2H3PO4 + 2H2O
7. Азотная кислота при нагревании окисляет
фосфор
t
P + 5HNO3(к) → 5NO2↑ + H3PO4 + H2O
3P + 5HNO3(разб) + 2H2O → 5NO↑ + 3H3PO4
Слайд 15Получение фосфора
Фосфор может быть получен
нагреванием смеси фосфорита, угля и
песка
в электропечи. Уравнение легче
составить, если представить протекание в
две стадии:
1) Ca3(PO4)2 + 3SiO2 → P2O5 + 3CaSiO3
2) P2O5 + 5C → 2P + 5CO
________________________________________
Ca3(PO4)2 + 5C + 3SiO2 → 2P + 3CaSiO3 + 5CO
составить, если представить протекание в
две стадии:
1) Ca3(PO4)2 + 3SiO2 → P2O5 + 3CaSiO3
2) P2O5 + 5C → 2P + 5CO
________________________________________
Ca3(PO4)2 + 5C + 3SiO2 → 2P + 3CaSiO3 + 5CO
Слайд 16Фосфин
Фосфор в степени окисления -3 образует
водородное соединение фосфин PH3,
аналогичное
аммиаку. Эта степень окисления
менее характерна для фосфора, чем для азота.
Фосфин – ядовитый газ с чесночным
запахом, может быть получен из фосфида
цинка действием кислот или воды:
Zn3P2 + 6HCl → 2PH3 + 3ZnCl2
Основные свойства фосфина слабее, чем у
аммиака:
PH3 + HCl → PH4Cl
менее характерна для фосфора, чем для азота.
Фосфин – ядовитый газ с чесночным
запахом, может быть получен из фосфида
цинка действием кислот или воды:
Zn3P2 + 6HCl → 2PH3 + 3ZnCl2
Основные свойства фосфина слабее, чем у
аммиака:
PH3 + HCl → PH4Cl
Слайд 17 Соли фосфония в водных растворах
неустойчивы:
PH4+ + H2O → PH3 +
H3O+
Фосфин имеет восстановительные свойства
(низшая степень окисления фосфора), горит на
воздухе (самовоспламеняется):
2PH3 + 4O2 → P2O5 + 3H2O или
PH3 + 2O2 → H3PO4
Фосфин окисляется очень многими окислителями
PH3 + 8HNO3(к) → 8NO2↑ + H3PO4 + 4H2O
Фосфид цинка используется в качестве
зооцида для борьбы с грызунами.
Фосфин имеет восстановительные свойства
(низшая степень окисления фосфора), горит на
воздухе (самовоспламеняется):
2PH3 + 4O2 → P2O5 + 3H2O или
PH3 + 2O2 → H3PO4
Фосфин окисляется очень многими окислителями
PH3 + 8HNO3(к) → 8NO2↑ + H3PO4 + 4H2O
Фосфид цинка используется в качестве
зооцида для борьбы с грызунами.
Слайд 18Оксид фосфора (V)
Оксид фосфора(V) P2O5 (или P4O10)
образуется при горении фосфора на
воздухе.
4Р + 5О2 → 2Р2О5
Твердое кристаллическое вещество Р2О5
гигроскопично и используется как
водоотнимающее средство.
1. При взаимодействии с водой оксид
фосфора(V) образует на холоду
метафосфорную кислоту НРО3,
имеющую полимерное строение:
P2O5 + H2O → 2HPO3
4Р + 5О2 → 2Р2О5
Твердое кристаллическое вещество Р2О5
гигроскопично и используется как
водоотнимающее средство.
1. При взаимодействии с водой оксид
фосфора(V) образует на холоду
метафосфорную кислоту НРО3,
имеющую полимерное строение:
P2O5 + H2O → 2HPO3
Слайд 19или при нагревании ортофосфорную
кислоту Н3РО4.
P2O5 + 3H2O → 2H3PO4
2. Как
кислотный оксид, вступает в реакции с
основными оксидами:
P2O5 + 3CaO → Ca3(PO4)2
3. С щелочами:
P2O5 +3Ca(OH)2 → Ca3(PO4)2 + 3H2O
основными оксидами:
P2O5 + 3CaO → Ca3(PO4)2
3. С щелочами:
P2O5 +3Ca(OH)2 → Ca3(PO4)2 + 3H2O
Слайд 20Ортофосфорная кислота
В промышленности фосфорную
кислоту получают действием серной
кислоты на фосфорит:
Ca3(PO4)2 +
3H2SO4 → 3CaSO4 + 2H3PO4
Ортофосфорная кислота представляет
собой кристаллическое вещество (tпл = 42ºС),
растворимое в воде. Как трехосновная кислота
средней силы диссоциирует ступенчато. Она
вступает во многие реакции, характерные для
кислот.
Ортофосфорная кислота представляет
собой кристаллическое вещество (tпл = 42ºС),
растворимое в воде. Как трехосновная кислота
средней силы диссоциирует ступенчато. Она
вступает во многие реакции, характерные для
кислот.
Слайд 21Химические свойства фосфорной кислоты
1.С металлами, стоящими в ряду напряжения
металлов до
водорода:
3Mg + 2H3PO4 → Mg3(PO4)2 + 3H2↑
2.С основными оксидами:
3CaO + 2H3PO4 → Сa3(PO4)2 + 3H2O
3.С основаниями и аммиаком:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + NH3 → (NH4)2HPO4
3Mg + 2H3PO4 → Mg3(PO4)2 + 3H2↑
2.С основными оксидами:
3CaO + 2H3PO4 → Сa3(PO4)2 + 3H2O
3.С основаниями и аммиаком:
H3PO4 + NaOH → NaH2PO4 + H2O
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + NH3 → (NH4)2HPO4
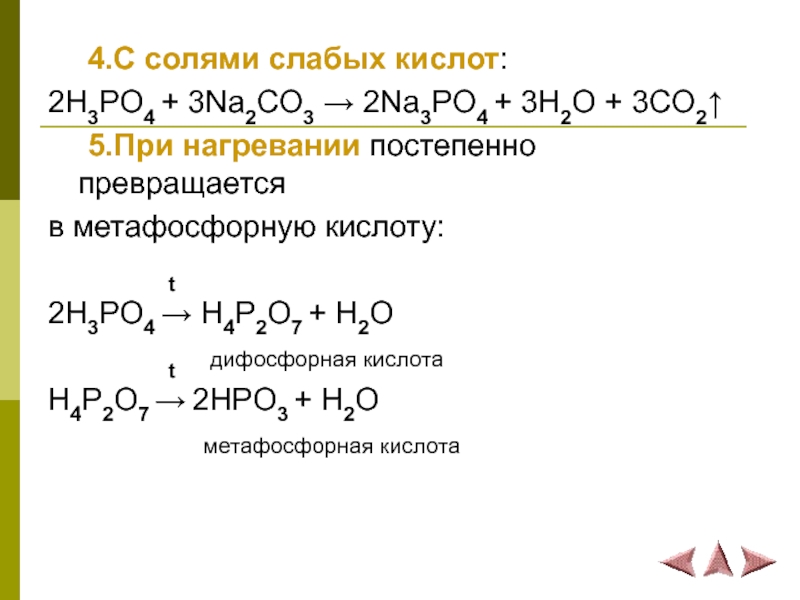
Слайд 22 4.С солями слабых кислот:
2H3PO4 + 3Na2CO3 → 2Na3PO4 + 3H2O +
3CO2↑
5.При нагревании постепенно превращается
в метафосфорную кислоту:
t
2H3PO4 → H4P2O7 + H2O
t дифосфорная кислота
H4P2O7 → 2HPO3 + H2O
метафосфорная кислота
5.При нагревании постепенно превращается
в метафосфорную кислоту:
t
2H3PO4 → H4P2O7 + H2O
t дифосфорная кислота
H4P2O7 → 2HPO3 + H2O
метафосфорная кислота
Слайд 236.При действии раствора нитрата серебра
появляется желтый осадок:
H3PO4 + 3AgNO3
→ Ag3PO4 ↓ + 3HNO3
желтый осадок
Это качественная реакция на фосфорную
кислоты и её соли – фосфаты.
желтый осадок
Это качественная реакция на фосфорную
кислоты и её соли – фосфаты.
Слайд 24Соли фосфорной кислоты
Различают средние соли - фосфаты (Na3PO4)
и кислые соли
- гидрофосфаты (Na2HPO4) и
дигидрофосфаты (NaH2PO4).
Растворимы в воде фосфаты и
гидрофосфаты щелочных металлов и аммония.
Все дигидрофосфаты растворимы в воде.
Фосфорная кислота вытесняется более
сильными кислотами из её солей:
Сa3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
конц.
дигидрофосфаты (NaH2PO4).
Растворимы в воде фосфаты и
гидрофосфаты щелочных металлов и аммония.
Все дигидрофосфаты растворимы в воде.
Фосфорная кислота вытесняется более
сильными кислотами из её солей:
Сa3(PO4)2 + 3H2SO4 → 3CaSO4 + 2H3PO4
конц.