МЕТАНА»
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Электронное и пространственное строение молекулы метана (10 класс)
Содержание
- 1. Презентация по химии Электронное и пространственное строение молекулы метана (10 класс)
- 2. Метан относится к предельным углеводородам –
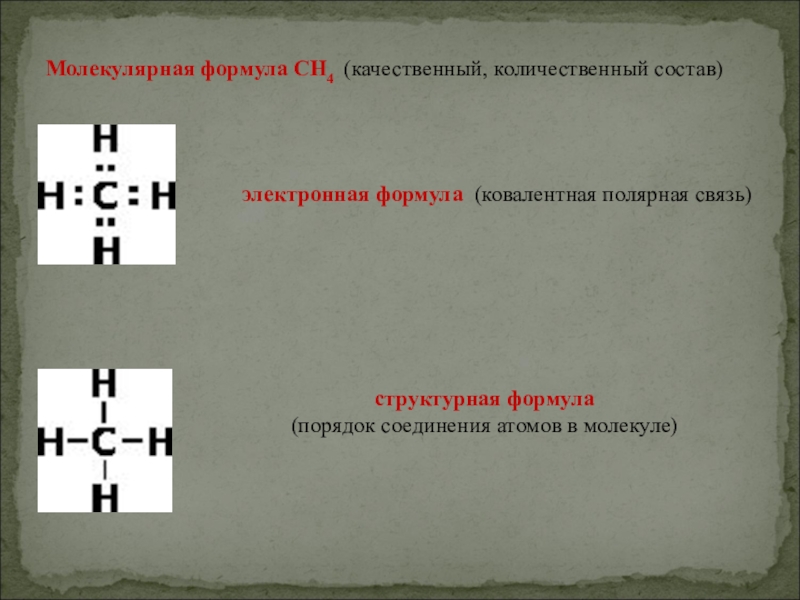
- 3. Молекулярная формула CH4 (качественный, количественный состав)электронная формула (ковалентная полярная связь)структурная формула (порядок соединения атомов в молекуле)
- 4. Молекула метана в действительности имеет форму тетраэдра.Почему
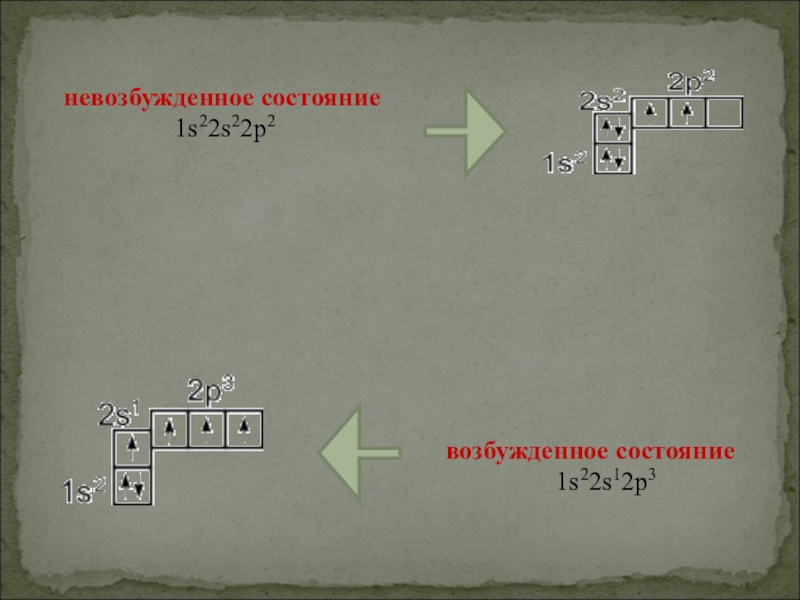
- 5. невозбужденное состояние 1s22s22p2 возбужденное состояние1s22s12p3
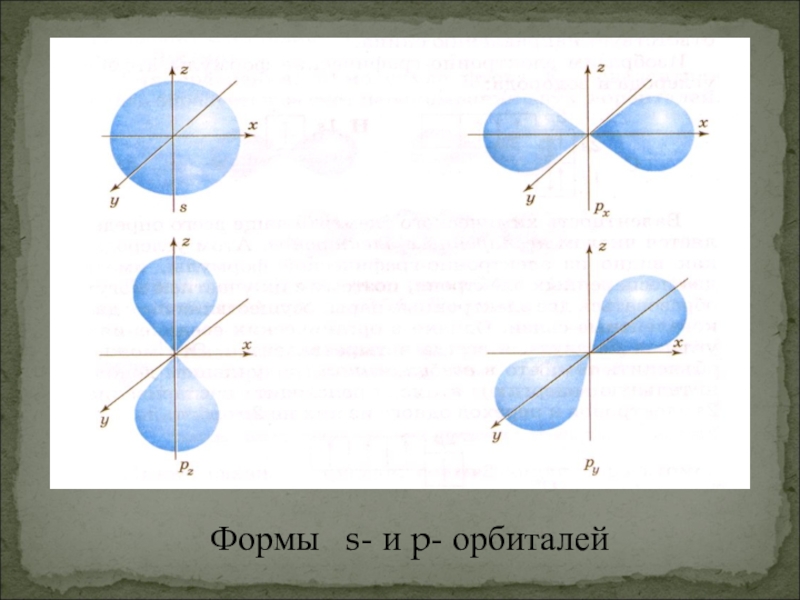
- 6. Формы s- и p- орбиталей
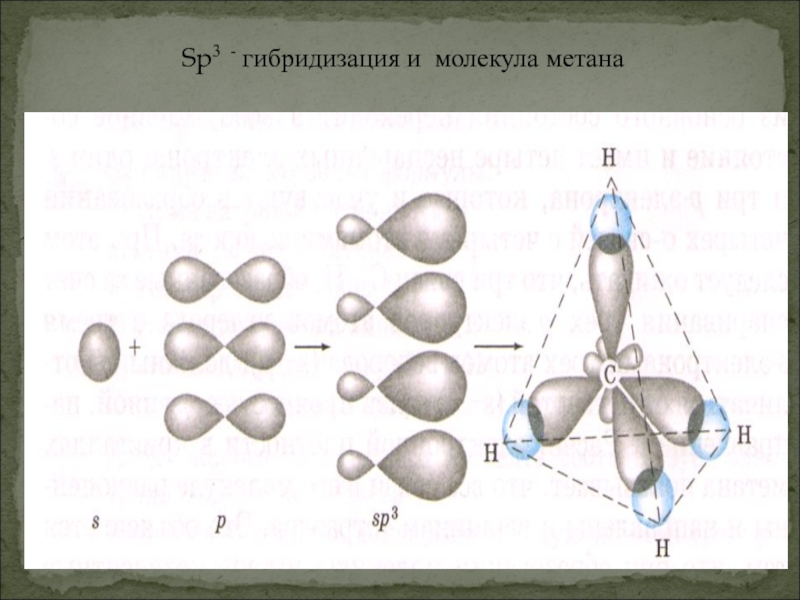
- 7. Sp3 - гибридизация и молекула метана
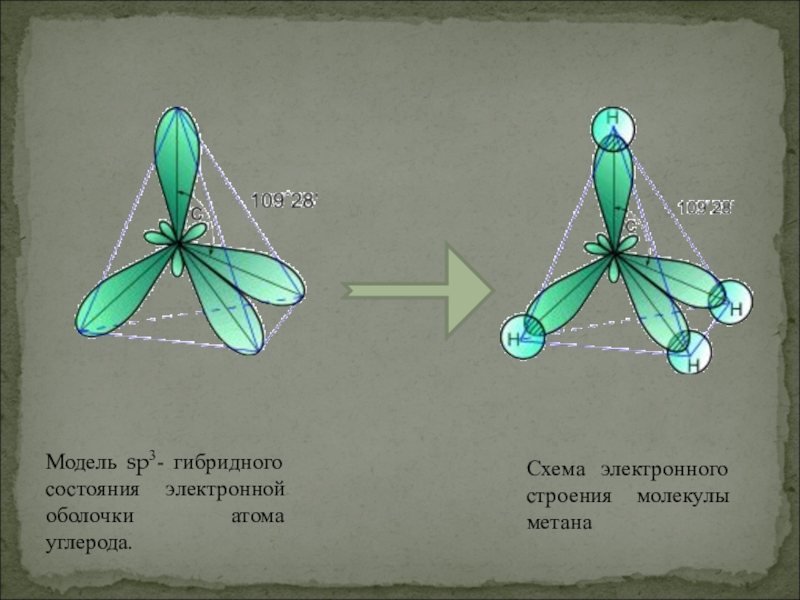
- 8. Модель sp3- гибридного состояния электронной оболочки атома углерода.Схема электронного строения молекулы метана
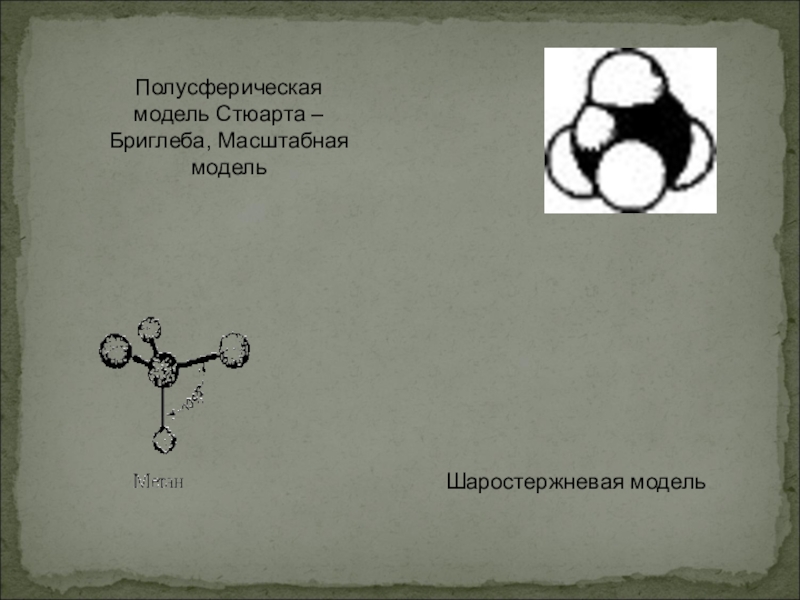
- 9. Полусферическая модель Стюарта – Бриглеба, Масштабная модель Шаростержневая модель
- 10. Вывод:Итак, молекула метана имеет тетраэдрическое строение, что
- 11. Слайд 11
- 12. Проверка усвоения темы :1. Укажите ошибочное определение
- 13. 4. Невозбуждённый атом углерода имеет электронную конфигурацию:
Метан относится к предельным углеводородам – алканам (парафинам) В обычных условиях алканы мало реакционноспособны, откуда возникло их название "парафины" – от лат. parrum affinis – малоактивный.общая формула - CnH2n+2
Слайд 2 Метан относится к предельным углеводородам – алканам (парафинам)
В обычных
условиях алканы мало реакционноспособны, откуда возникло их название "парафины" – от лат. parrum affinis – малоактивный.
общая формула - CnH2n+2
Слайд 3Молекулярная формула CH4 (качественный, количественный состав)
электронная формула (ковалентная полярная связь)
структурная формула
(порядок соединения атомов в молекуле)
Слайд 4Молекула метана в действительности имеет форму тетраэдра.
Почему молекула метана имеет такую
пространственную форму?
Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра?
Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра?
Слайд 8Модель sp3- гибридного состояния электронной оболочки атома углерода.
Схема электронного строения молекулы
метана
Слайд 10Вывод:
Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода,
тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода.
Слайд 12Проверка усвоения темы :
1. Укажите ошибочное определение метана:
а) предельный углеводород;
б)
карбоциклическое соединение;
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула метана:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение метана:
а) SP3-гибридизация, плоская форма молекул, угол - 120о σ и π-связи;
б) SP-гибридизация, линейная форма молекул, угол 180о, σ и π-связи;
в) SP3-гибридизация, пространственная форма молекул, угол 109о28' , σ -связи.
в) насыщенные углеводороды;
г) парафиновые углеводороды.
2. Общая формула метана:
а) СnH2n;
б) СnH2n+1;
в) СnH2n+2;
г) СnН2n-2.
3. Признаки, характеризующие строение метана:
а) SP3-гибридизация, плоская форма молекул, угол - 120о σ и π-связи;
б) SP-гибридизация, линейная форма молекул, угол 180о, σ и π-связи;
в) SP3-гибридизация, пространственная форма молекул, угол 109о28' , σ -связи.
Слайд 134. Невозбуждённый атом углерода имеет электронную конфигурацию:
а) 1S22S12P3;
б) 1S22S22P2;
в) 1S22S22P3;
г)
1S22S22P4.
5. Возбужденный атом углерода имеет электронную конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
6. Какой фигурой отражено пространственное строение метана:
а)Куб;
б)Октаэдр
в)Тетраэдр
г)Призма
7. Тип химической связи в молекуле метана:
а)Ионная;
б)Ковалентная полярная;
в)Водородная;
г)Ковалентная неполярная.
5. Возбужденный атом углерода имеет электронную конфигурацию:
а) 1S22S22P3;
б) 1S22S22P2;
в) 1S22S22P4;
г) 1S22S12P3.
6. Какой фигурой отражено пространственное строение метана:
а)Куб;
б)Октаэдр
в)Тетраэдр
г)Призма
7. Тип химической связи в молекуле метана:
а)Ионная;
б)Ковалентная полярная;
в)Водородная;
г)Ковалентная неполярная.