- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Электролиз 11 класс
Содержание
- 1. Презентация по химии Электролиз 11 класс
- 2. Слайд 2
- 3. Электролиз водных растворов и расплавов электролитов. Мастер – класс (в целях подготовки к итоговой аттестации)
- 4. Изюмина Н.Н. учитель высшей квалификационной категории МКОУ «СОШ№6»
- 5. Слайд 5
- 6. Электролиз - окислительно –
- 7. Слайд 7
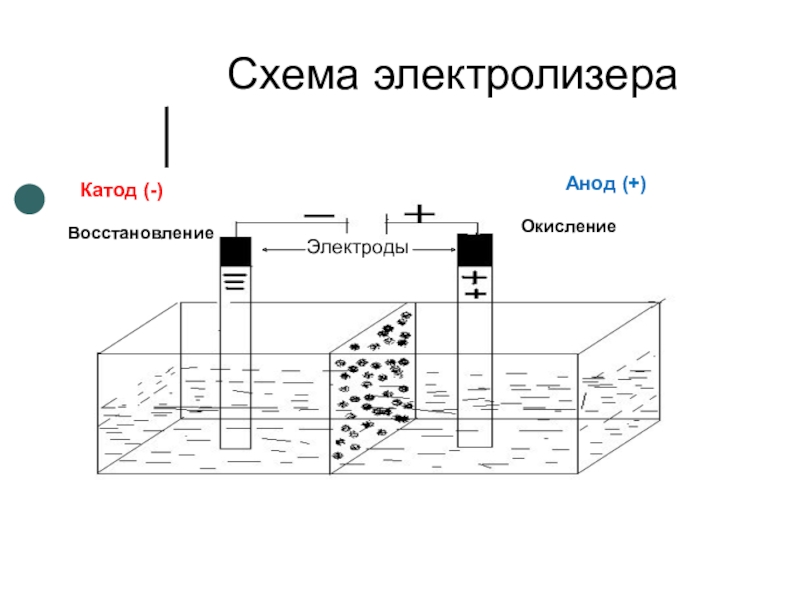
- 8. Схема электролизераВосстановлениеОкислениеКатод (-)Анод (+)Электроды
- 9. Слайд 9
- 10. Процесс на катоде зависит от положения
- 11. М n+ + n e-
- 12. 3. Катион электролита расположен в ряду
- 13. Процесс на аноде зависит от материала анода
- 14. При наличии в растворе ионов _
- 15. Электролиз солей карбоновых кислот. Реакция Кольбе –
- 16. При наличии в растворе ионов кислородсодержащих кислот
- 17. Задание №1 Напишите уравнение
- 18. Применение электролизаЭлектрометаллургия: а) получение активных металлов (K,
- 19. Слайд 19
- 20. Домашнее задание:§18, стр.217-222, №22,26, З.28с.224, КИМ ЕГЭ; №29, В1-10, 2016г.
- 21. Спасибо за внимание! До новых встреч!
Слайд 1Районный семинар учителей химии и биологии Благодарненского района
Ставропольского края
26 февраля 2016год
Слайд 3Электролиз водных растворов и расплавов электролитов.
Мастер – класс
(в целях
Слайд 5 Цель: сформировать у учащихся понятие электролиз, как окислительно-восстановительный процесс и получение
Слайд 6
Электролиз -
окислительно – восстановительный процесс, протекающий на
электродах при
электрического тока через расплав или
водный раствор электролита.
Слайд 10 Процесс на катоде зависит от положения металла в электрохимическом ряду
Li Cs Rb K Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb Н
Cu Hg AgPt Au
Катион электролита расположен в ряду напряжений металлов в начале ряда по Al включительно, выделяется из расплавов, а в водных растворах идёт процесс восстановления воды с выделением водорода:
_ _
2Н2О + 2 е → 2ОН + Н2 ↑
Слайд 11 М n+ + n e- → M0;
2. Катион электролита расположен в ряду напряжений металлов между Al и H, то на катоде восстанавливаются одновременно и катионы металла, и молекулы воды с выделением водорода.
Слайд 12 3. Катион электролита расположен в
ряду напряжений металлов после H,
_
М n+ + n e → M0;
4. В растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла , стоящего в ряду напряжений правее.
Слайд 13Процесс на аноде зависит от материала анода и от природы аниона.
1.
_
М 0 - n e → М n+ ;
анод раствор
Слайд 14При наличии в растворе ионов
_ _ _
Cl , Br, I , S происходит окисление этих частиц до простых веществ.
Слайд 15Электролиз солей карбоновых кислот.
Реакция Кольбе – синтез алканов с четным числом
A(+) CH3COO- - e- → CH3COO.
неустойчивый радикал кислоты
CH3 : COO . → CH3 . + СО2
CH3 . + СН3. → CH3 - СН3
К(-) 2H2O + 2e- → H2 + 2OH-
Уравнение электролиза:
2CH3COONа +2 Н2О → CH3- СН3 + СО2↑ + Н2 ↑ + 2NaOH
на аноде на катоде у катода
Слайд 16
При наличии в растворе ионов кислородсодержащих кислот и фторид F– анионов
- +
2Н2О – 4 е → О2 + 4Н
Слайд 17 Задание №1 Напишите уравнение реакции, протекающие на катоде
2+ 2-
ZnSO4 = Zn + SO4
+ _
Н2О = H + OH
на катоде (-) на аноде (+)
2+ _ 0 _ _
Zn + 2 е → Zn 4ОН – 4 е → О2 + 2Н2О
_ _ _ +
2Н2О + 2 е → 2ОН + Н2 ↑ 2Н2О – 4 е → О2 + 4Н
Суммарное молекулярное уравнение:
ZnSO4 + 2Н2О → Zn + Н2 + О2 + Н2 SO4 (если полный распад соли);
2ZnSO4 + 4 Н2О → Zn + 3Н2 + О2 + 2 Н2 SO4 + Zn(ОН)2 ↓
Слайд 18Применение электролиза
Электрометаллургия: а) получение активных металлов (K, Na, Ca, Mg, Al
В химической промышленности – получение газов: F2, Cl2, H2, O2; щелочей: NaOH, KOH; пероксида водородаH2O2, тяжелой воды D2O и др.
Электролитическое рафинирование – очистка металлов (Cu, Pb, Sn и др.) от примесей электролизом с применением активных (растворимых) анодов.
Гальванопластика – получение металлических копий с различных матриц, а также покрытие неметаллических предметов слоем металлов. Последний процесс (золочение деревянных статуй и ваз) был известен еще в Древнем Египте, но научные основы гальванопластики были заложены русским ученым Б. Якоби в 1838 г.