- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Электролитическая диссоциация (8 класс)
Содержание
- 1. Презентация по химии Электролитическая диссоциация (8 класс)
- 2. Цели урока:Сформировать понятие об электролитах и неэлектролитах;Дать
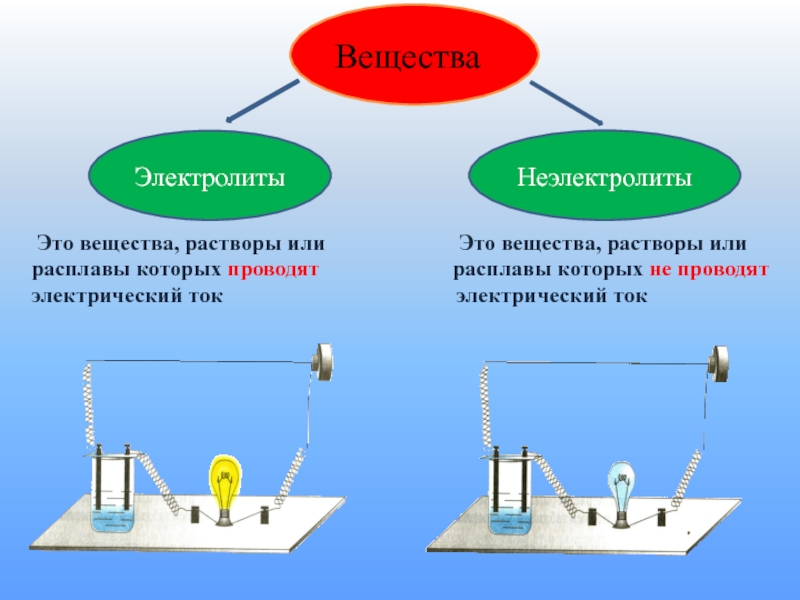
- 3. Это вещества, растворы или
- 4. Электролитическая диссоциация – распад электролита
- 5. Вид химической
- 6. Шведский ученый Сванте Аррениус (1859-1927)
- 7. Русские химики И.А.Каблуков и В.А.Кистяковский применили
- 8. Слайд 8
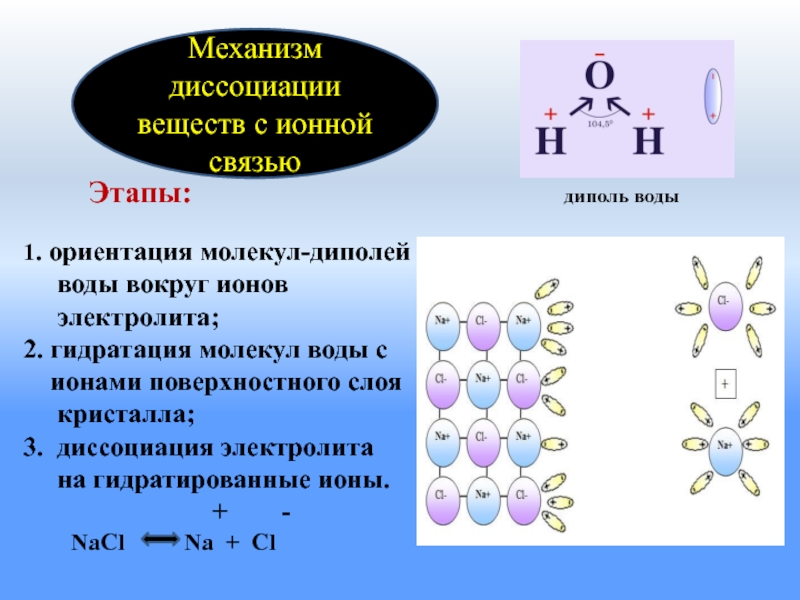
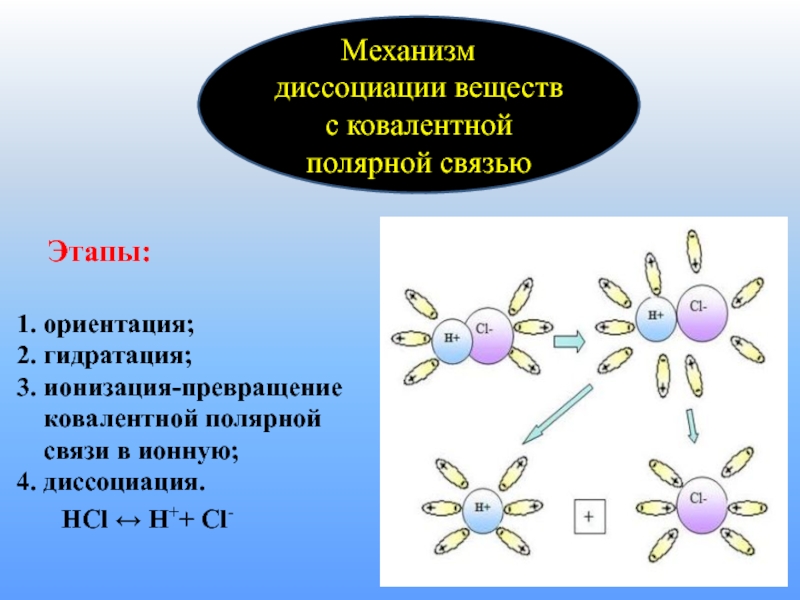
- 9. Этапы:
- 10. Слайд 10
- 11. Степень
- 12. Классификация электролитов Средние Сильные
- 13. § 36, конспект, упр.1-6Домашнее задание
Слайд 1
Химия 8 класс
Презентация на тему:
«Электролитическая диссоциация»
Выполнила: Шамина Виктория Викторовна
учитель химии МОУ «Грицовский ЦО
им.Д.С.Сидорова»
Веневского района Тульской области
Слайд 2Цели урока:
Сформировать понятие об электролитах и неэлектролитах;
Дать определение электролитической диссоциации;
Рассмотреть механизм
Ввести понятие степени диссоциации и ее зависимости от различных факторов;
Рассмотреть классификацию электролитов (сильные и слабые).
Оборудование и реактивы:
Прибор для исследования электропроводности веществ с электрической лампочкой;
Дистиллированная вода, кристаллический NaCl, раствор NaCl, раствор NaOH, раствор H2SO4, раствор CuSO4, кристаллы сахара, этиловый спирт, раствор уксусной кислоты.
Слайд 3
Это вещества, растворы или
расплавы которых проводят расплавы которых не проводят
электрический ток электрический ток
Электролиты
Неэлектролиты
Вещества
Слайд 4 Электролитическая диссоциация – распад электролита на ионы при растворении в воде
Слайд 5
Вид химической связи:
ковалентная сильнополярная
Растворимые основания
(щелочи):
Примеры: NaOH, KOH, Ca(OH)2,
Вa(OH)2
Растворимые кислоты:
Примеры: HCl, H2SO4, HNO3,
H3PO4
Растворимые соли:
Примеры: NaCl, K2SO4, CuSO4,
Ca(NO3)2, Na2CO3
Вид химической связи: ковалентная неполярная или малополярная
Нерастворимые основания:
Примеры: Сu(OH)2, Fe(OH)3
Нерастворимые кислоты:
Примеры: H2SiO3
Нерастворимые соли:
Примеры: CuS, Ca3(PO4)2, AgCl
Оксиды:
Примеры: Na2O, CuO, CaO, NO
Простые вещества:
Примеры: N2, O2, I2, Cl2
Органические вещества:
Примеры: сахар С12H22O11, глюкоза C6H12O6, метан СН4
Электролиты
Неэлектролиты
Слайд 6Шведский ученый Сванте Аррениус (1859-1927)
Один из основоположников физической
В 1887 году создал теорию электролитической диссоциации
В 1903году был удостоен Нобелевской премии
"За чрезвычайные заслуги в развитии
химии".
Слайд 7 Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации
Каблуков И.А.
Кистяковский В.А. Менделеев Д.И.
Слайд 8
Механизм диссоциации веществ с ионной связью
Слайд 9 Этапы: 1. ориентация; 2. гидратация; 3. ионизация-превращение ковалентной
Механизм
диссоциации веществ с ковалентной полярной связью
НСl ↔ H++ Cl-
Слайд 11 Степень диссоциации (альфа)-
Слайд 12Классификация электролитов
Средние
Сильные
→1
( >30%) ( от 3% до 30%)
Н2SO4 HCl H3PO4 HNO2 H2CO3
HNO3 NaOH Н2S H2SO3
СuSO4 NaCl H2O Al(OH)3
NH3 *H2O
Ca3(PO4)2
Слабые
→0
( < 3%)