- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Электролитическая диссоциация (11 класс)
Содержание
- 1. Презентация по химии Электролитическая диссоциация (11 класс)
- 2. Электролитическая диссоциация -Процесс распада электролита на ионы при его растворении в воде или расплавлении.
- 3. ВеществаЭлектролиты –Вещества, которые проводят эл.токВсе растворимые соли,
- 4. Степень диссоциации -Это отношение числа проциссоциированных молекул к общему числу молекул.а = Nд / Nобщ
- 5. ЭлектролитыСильныеα → 1Растворимые солиСильные кислоты (HCl, H2SO4,
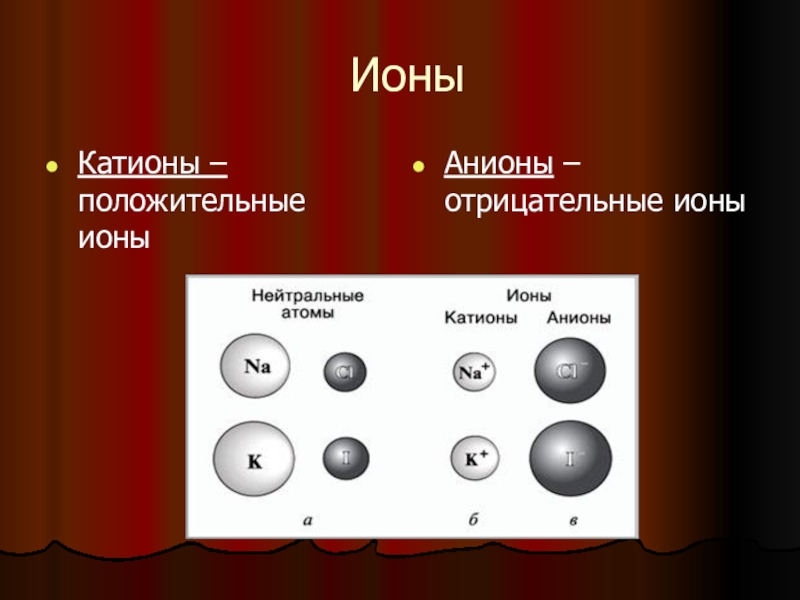
- 6. ИоныКатионы – положительные ионыАнионы – отрицательные ионы
- 7. Кислоты -Это электролиты, при диссоциации которых в
- 8. Слайд 8
- 9. Основания -Это электролиты, при диссоциации которых в качестве анионов образуются ионы OH-.NaOH → Na + OH
- 10. Соли -Это электролиты, которые диссоциируют на катионы Ме и анионы кислотных остатков.NaCl → Na + Cl
- 11. Реакции обмена в растворах электролитов протекают до конца:Если образуетсяГазВодаНерастворимое вещество
- 12. Домашнее задание§ 17Вопросы 7,8,10.
- 13. Степень диссоциации уксусной кислоты в водном растворе
- 14. Сокращенное ионное уравнение Fe2+ + 2OH–
- 15. Диссоциация по трем ступеням возможна в растворе1) хлорида алюминия 2) ортофосфата калия3) нитрата алюминия 4) ортофосфорной кислоты
- 16. Сокращенное ионное уравнение реакции Cu2+ +
- 17. В качестве катионов только ионы Н+ образуются
- 18. Совместно находиться в растворе могут 1) катион
Электролитическая диссоциация -Процесс распада электролита на ионы при его растворении в воде или расплавлении.
Слайд 2Электролитическая диссоциация -
Процесс распада электролита на ионы при его растворении в
воде или расплавлении.
Слайд 3Вещества
Электролиты –
Вещества, которые проводят эл.ток
Все растворимые соли, кислоты, основания
Имеют ионный или
ковалентный сильно полярный тип связи.
Неэлектролиты –
Вещества, которые не проводят эл.ток
Простые в-ва, газы, нерастворимые соли кислоты, основания, большинство органических в-в
Имеют ковалентный полярный или неполярный тип связи
Слайд 4Степень диссоциации -
Это отношение числа проциссоциированных молекул к общему числу молекул.
а
= Nд / Nобщ
Слайд 5Электролиты
Сильные
α → 1
Растворимые соли
Сильные кислоты (HCl, H2SO4, HNO3)
Щёлочи (NaOH, LiOH, KOH,
Ca(OH)2, Ba(OH)2
HCL → H + Cl
HCL → H + Cl
Слабые
α → 0
Слабые кислоты (H2S, H2CO3)
Все органические кислоты
Вода
H2CO3 ↔ 2H + CO3
Слайд 7Кислоты -
Это электролиты, при диссоциации которых в качестве катионов образуются ионы
H+.
HCl → H + Cl
H3PO4
HCl → H + Cl
H3PO4
Слайд 9Основания -
Это электролиты, при диссоциации которых в качестве анионов образуются ионы
OH-.
NaOH → Na + OH
NaOH → Na + OH
Слайд 10Соли -
Это электролиты, которые диссоциируют на катионы Ме и анионы кислотных
остатков.
NaCl → Na + Cl
NaCl → Na + Cl
Слайд 11Реакции обмена в растворах электролитов протекают до конца:
Если образуется
Газ
Вода
Нерастворимое вещество
Слайд 13Степень диссоциации уксусной кислоты в водном растворе увеличится, если
1) интенсивно
перемешать этот раствор
2) добавить в раствор CH3COONa
3) разбавить раствор CH3COOH водой
4) увеличить концентрацию CH3COOH
2) добавить в раствор CH3COONa
3) разбавить раствор CH3COOH водой
4) увеличить концентрацию CH3COOH
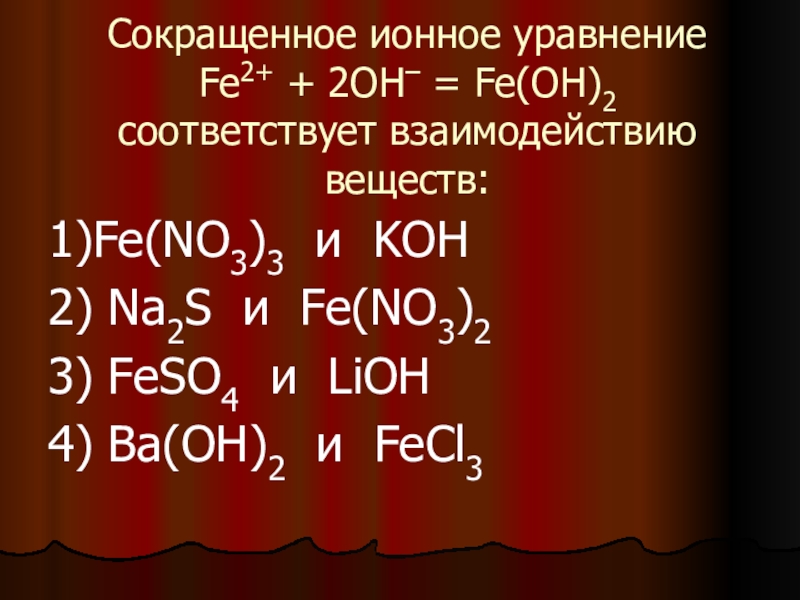
Слайд 14Сокращенное ионное уравнение
Fe2+ + 2OH– = Fe(OH)2
соответствует взаимодействию веществ:
1)Fe(NO3)3 и
KOH
2) Na2S и Fe(NO3)2
3) FeSO4 и LiOH
4) Ba(OH)2 и FeCl3
2) Na2S и Fe(NO3)2
3) FeSO4 и LiOH
4) Ba(OH)2 и FeCl3
Слайд 15Диссоциация по трем ступеням возможна в растворе
1) хлорида алюминия
2) ортофосфата калия
3)
нитрата алюминия
4) ортофосфорной кислоты
4) ортофосфорной кислоты
Слайд 16Сокращенное ионное уравнение реакции
Cu2+ + S2– = CuS↓
соответствует взаимодействию
сульфата меди
(II) и сульфида аммония
гидроксида меди (II) и сероводород
карбоната меди (II) и сульфида аммония
4) нитрата меди (II) и сероводорода
гидроксида меди (II) и сероводород
карбоната меди (II) и сульфида аммония
4) нитрата меди (II) и сероводорода
Слайд 17В качестве катионов только ионы Н+ образуются при диссоциации
NaOH
2) NaH2PO4
3) H2SO4 4) NaHSO4
3) H2SO4 4) NaHSO4
Слайд 18Совместно находиться в растворе могут
1) катион натрия и гидроксид-ион
2) катион
цинка и гидроксид-ион
3) катион алюминия и гидроксид-ион
4) катион меди и гидроксид-ион
3) катион алюминия и гидроксид-ион
4) катион меди и гидроксид-ион