Карташова Э.А.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии для 10 класса к уроку Химические свойства алкенов
Содержание
- 1. Презентация по химии для 10 класса к уроку Химические свойства алкенов
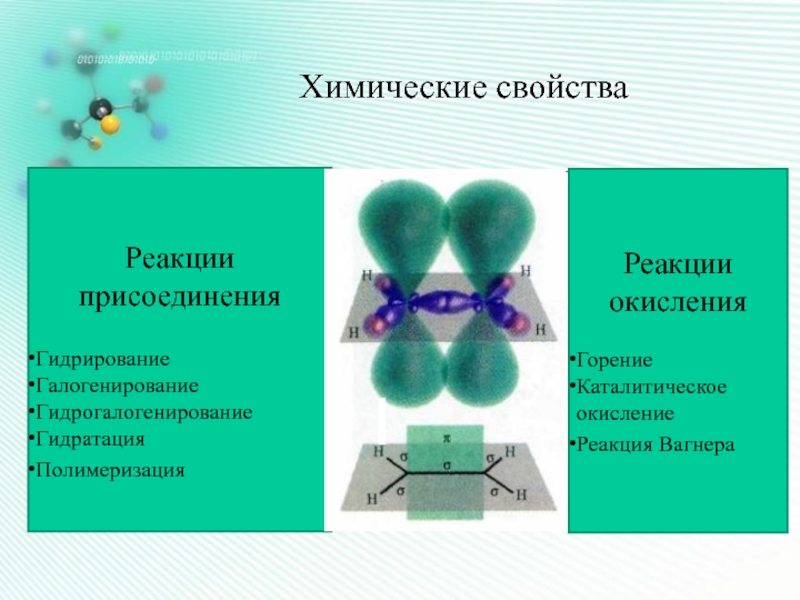
- 2. Химические свойства Реакции присоединенияГидрирование ГалогенированиеГидрогалогенирование Гидратация Полимеризация Реакции окисленияГорение Каталитическое окислениеРеакция Вагнера
- 3. Реакции присоединения
- 4. Слайд 4
- 5. Правила техники безопасностиСоблюдайте осторожность при работе
- 6. Реакции окисления алкеновПолное окисление (горение):
- 7. Реакции окисления алкеновСтроение продуктов окисления алкенов зависит
- 8. Взаимодействия алкенов с раствором KMnO4 в
- 9. Взаимодействия алкенов с раствором KMnO4 в
- 10. Закрепление СН3-СН=СН-СН3 + КMnO4 + H2SO4 →
- 11. Проверка 5 СН3-СН=СН-СН3 + 8 КMnO4 +
- 12. Закончите предложения:Сегодня я узнал ……………..Я удивился ……………………….Теперь я умею ………………Я хотел бы узнать ……………
- 13. Домашнее задание. § 12 читать, № 4,
- 14. Литература Габриелян О.С., Остроумов И.Г., Карцова А.А.
Химические свойства Реакции присоединенияГидрирование ГалогенированиеГидрогалогенирование Гидратация Полимеризация Реакции окисленияГорение Каталитическое окислениеРеакция Вагнера
Слайд 1МОУ «Майская гимназия
Белгородского района Белгородской области»
Химические свойства алкенов
10 класс
Учитель химии
Слайд 2Химические свойства
Реакции присоединения
Гидрирование
Галогенирование
Гидрогалогенирование
Гидратация
Полимеризация
Реакции окисления
Горение
Каталитическое окисление
Реакция
Вагнера
Слайд 4
Цель работы – провести исследование
по изучению химических свойств алкенов
Метод исследования - химический эксперимент
(работа в группах по 2 человека)
Задание группе №1 Рассмотреть реакцию горения этилена
Задание группе №2 Рассмотреть реакцию окисления этилена
(в мягких условиях)
Задание группе №3 Обнаружить алкены в бензине
Задание группе №4 Рассмотреть реакцию
присоединения
по изучению химических свойств алкенов
Метод исследования - химический эксперимент
(работа в группах по 2 человека)
Задание группе №1 Рассмотреть реакцию горения этилена
Задание группе №2 Рассмотреть реакцию окисления этилена
(в мягких условиях)
Задание группе №3 Обнаружить алкены в бензине
Задание группе №4 Рассмотреть реакцию
присоединения
Слайд 5Правила техники
безопасности
Соблюдайте осторожность при работе с кислотами и щелочами!
В случае
попадания на кожу – промойте водой!
После промывания водой раствор кислоты нейтрализуют слабым раствором соды.
Нагревайте осторожно,
сначала всю пробирку,
затем ту часть, где находится реакционная смесь.
После промывания водой раствор кислоты нейтрализуют слабым раствором соды.
Нагревайте осторожно,
сначала всю пробирку,
затем ту часть, где находится реакционная смесь.
Слайд 6 Реакции окисления алкенов
Полное окисление (горение):
Промышленное значение имеет частичное
окисление
алкенов с образованием циклических оксидов
алкенов с образованием циклических оксидов
Слайд 7Реакции окисления алкенов
Строение продуктов окисления алкенов зависит
от условий реакции и
природы окислителя
Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию
двухатомных спиртов (реакция Вагнера)
Качественная реакция на алкены.
Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию
двухатомных спиртов (реакция Вагнера)
Качественная реакция на алкены.
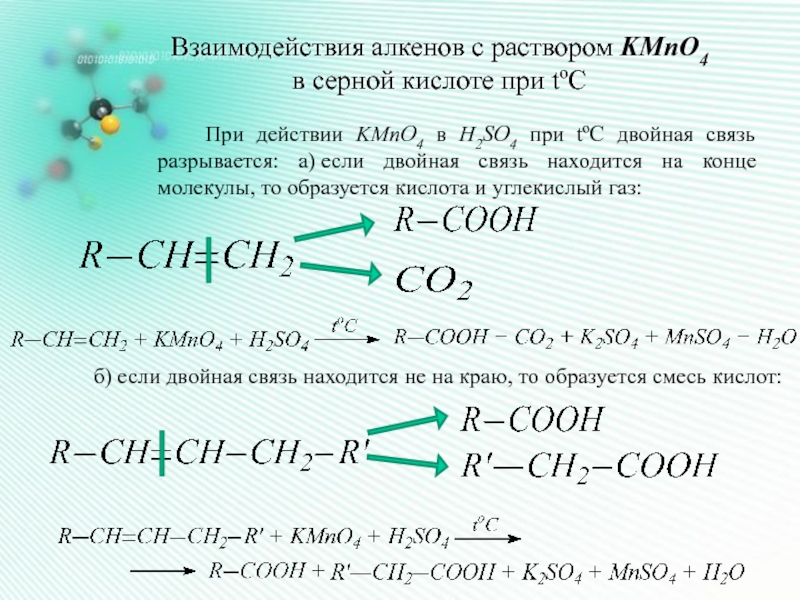
Слайд 8Взаимодействия алкенов с раствором KMnO4
в серной кислоте при tºC
При действии
KMnO4 в H2SO4 при tºC двойная связь разрывается: а) если двойная связь находится на конце молекулы, то образуется кислота и углекислый газ:
б) если двойная связь находится не на краю, то образуется смесь кислот:
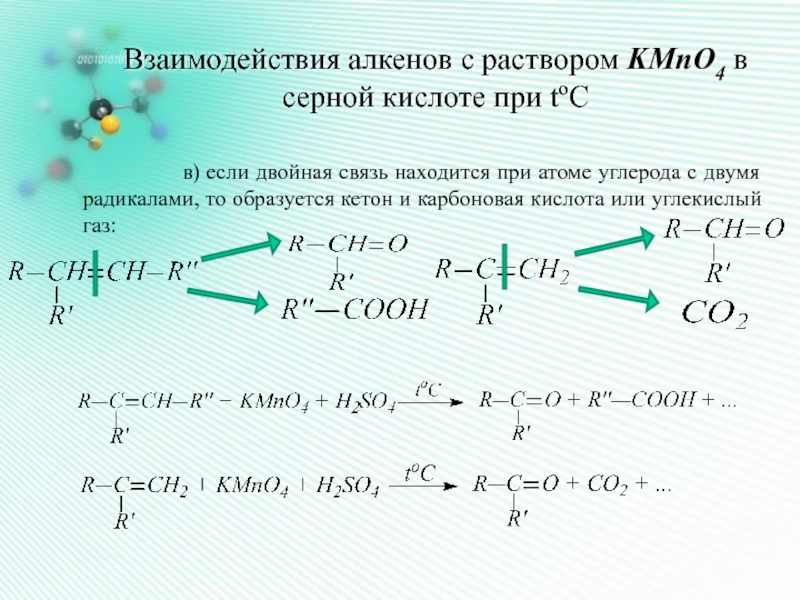
Слайд 9Взаимодействия алкенов с раствором KMnO4 в
серной кислоте при tºC
в) если двойная связь находится при атоме углерода с двумя радикалами, то образуется кетон и карбоновая кислота или углекислый газ:
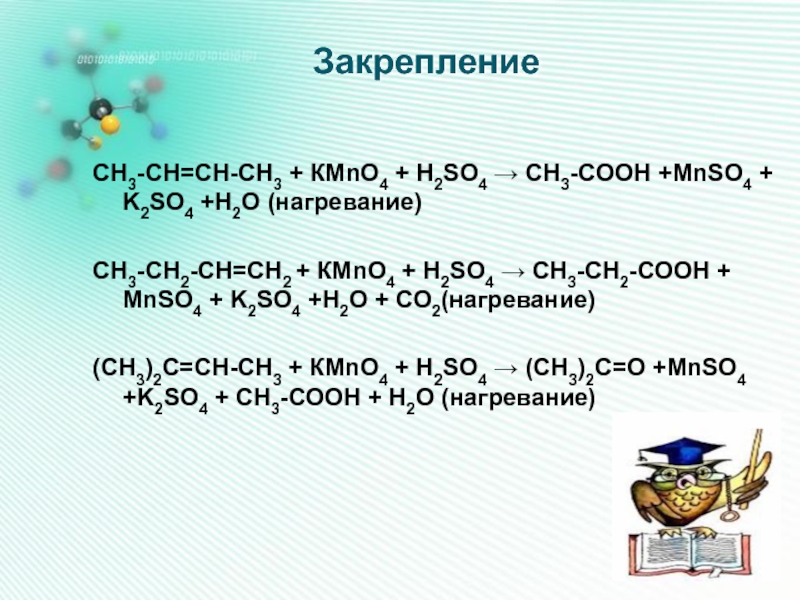
Слайд 10Закрепление
СН3-СН=СН-СН3 + КMnO4 + H2SO4 → CH3-COOH +MnSO4 + K2SO4 +H2O
(нагревание)
СН3-СН2-СН=СН2 + КMnO4 + H2SO4 → СН3-СН2-СООН + MnSO4 + K2SO4 +H2O + СО2(нагревание)
(СН3)2С=СН-СН3 + КMnO4 + H2SO4 → (СН3)2С=О +MnSO4 +K2SO4 + СН3-СООН + H2O (нагревание)
СН3-СН2-СН=СН2 + КMnO4 + H2SO4 → СН3-СН2-СООН + MnSO4 + K2SO4 +H2O + СО2(нагревание)
(СН3)2С=СН-СН3 + КMnO4 + H2SO4 → (СН3)2С=О +MnSO4 +K2SO4 + СН3-СООН + H2O (нагревание)
Слайд 11Проверка
5 СН3-СН=СН-СН3 + 8 КMnO4 + 12 H2SO4 →10CH3-COOH + 8
MnSO4 + 4 K2SO4 + 12 H2O
СН3-СН2-СН=СН2 + 2 КMnO4 + 3 H2SO4 →СН3-СН2-СООН + 2 MnSO4 + K2SO4 + 4 H2O + СО2
5 (СН3)2С=СН-СН3 + 6 КMnO4 + 9 H2SO4 → 5(СН3)2С=О + 6MnSO4 +3K2SO4 + 5СН3-СООН + 9H2O
СН3-СН2-СН=СН2 + 2 КMnO4 + 3 H2SO4 →СН3-СН2-СООН + 2 MnSO4 + K2SO4 + 4 H2O + СО2
5 (СН3)2С=СН-СН3 + 6 КMnO4 + 9 H2SO4 → 5(СН3)2С=О + 6MnSO4 +3K2SO4 + 5СН3-СООН + 9H2O
Слайд 12Закончите предложения:
Сегодня я узнал ……………..
Я удивился ……………………….
Теперь я умею ………………
Я
хотел бы узнать ……………
Слайд 13
Домашнее задание. § 12 читать, № 4, 6, 7.
Задание №40 ЕГЭ
При
нагревании 120 г. предельного одноатомного спирта в присутствии концентрированной серной кислоты было получено 84 г. алкена. На основании данных:
1) произведите вычисления, необходимые для установления молекулярной формулы спирта и алкена;
2) запишите молекулярные формулы веществ;
3) составьте структурные формулы веществ, которые однозначно отражают порядок связи атомов в его молекуле;
4) напишите уравнение реакции.
Уравнения из задания №38 ЕГЭ
методом электронного баланса расставить коэффициенты
CH3CH=CHCH2CH3 +KMnO4+KOH→CH3COOK+C2H5COOK+ H2O + K2MnO4 (нагревание)
CH3CH=CH2+KMnO4 +KOH →CH3COOK +K2CO3+H2O + K2MnO4 (нагревание)
1) произведите вычисления, необходимые для установления молекулярной формулы спирта и алкена;
2) запишите молекулярные формулы веществ;
3) составьте структурные формулы веществ, которые однозначно отражают порядок связи атомов в его молекуле;
4) напишите уравнение реакции.
Уравнения из задания №38 ЕГЭ
методом электронного баланса расставить коэффициенты
CH3CH=CHCH2CH3 +KMnO4+KOH→CH3COOK+C2H5COOK+ H2O + K2MnO4 (нагревание)
CH3CH=CH2+KMnO4 +KOH →CH3COOK +K2CO3+H2O + K2MnO4 (нагревание)
Слайд 14Литература
Габриелян О.С., Остроумов И.Г., Карцова А.А. Органическая химия. – Москва. Просвещение.
2004.
Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия.- Москва. Дрофа. 2004.
Дерябина Н.Е. Органическая химия. Книга 1. Углеводороды и их монофункциональные производные. М. 2012.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии (в двух томах). – Москва. Экзамен. 2004.
Потапов В.М., Чертков И.Н. Строение и свойства органических соединений. – Москва. Просвещение, 1984.
http://school-collection.edu.ru. Единая коллекция цифровых образовательных ресурсов
Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия.- Москва. Дрофа. 2004.
Дерябина Н.Е. Органическая химия. Книга 1. Углеводороды и их монофункциональные производные. М. 2012.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии (в двух томах). – Москва. Экзамен. 2004.
Потапов В.М., Чертков И.Н. Строение и свойства органических соединений. – Москва. Просвещение, 1984.
http://school-collection.edu.ru. Единая коллекция цифровых образовательных ресурсов