- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Алюминий. Амфотерность. (9 класс)
Содержание
- 1. Презентация по химии Алюминий. Амфотерность. (9 класс)
- 2. Ложка
- 3. Тема урока:Алюминий.
- 4. Слайд 4
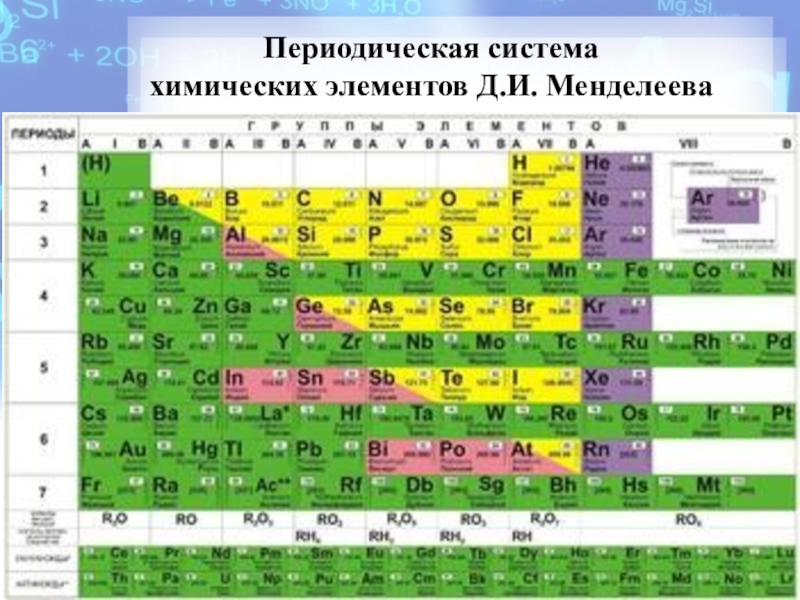
- 5. Периодическая система химических элементов Д.И. Менделеева
- 6. Тема урока:Алюминий.Амфотерность.
- 7. АМФ - < ГРЕЧ. («ОБА»)- ОТНОШЕНИЕ К ДВУМ ПРЕДМЕТАМ, ДВОЯКОСТЬ
- 8. Цель :узнать…понять…научиться…
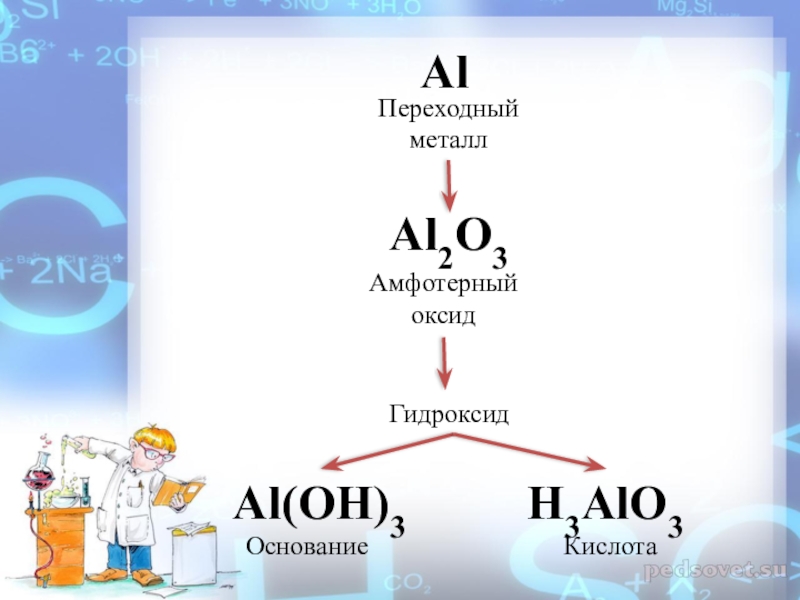
- 9. AlAl2O3Al(OH)3H3AlO3Переходный металлАмфотерный оксидКислота Основание Гидроксид
- 10. В электрохимическом ряду металлов алюминий следует за
- 11. Алгоритм работы в группе (Время работы –
- 12. Алюминий Формула – АlФизические свойства:металл серебристо-белого цвета;твердый;прочный;легкий;пластичный
- 13. Получение алюминия (Al)Алюминий в промышленности получают
- 14. Химические свойства алюминия (Al)1. Взаимодействие с
- 15. Оксид алюминия Формула – Аl2O3Физические свойства:Белое кристаллическое вещество, тугоплавкое, твердое
- 16. Получение оксида алюминия (Аl2O3)Термическое разложение гидроксида
- 17. Химические свойства оксида алюминия (Al2О3)1. Взаимодействие
- 18. Гидроксид алюминия Формула – Аl(OH)3Физические свойства:Белое студенистое, полимерное вещество, плохо растворимое в воде
- 19. Получение гидроксида алюминия (Аl(OН)3)Получают при взаимодействии солей алюминия с водными растворами щёлочи: AlCl3 +3NaOH=Al(OH)3 +3NaCl
- 20. Химические свойства гидроксида алюминия (Al(ОН)3)1.Термическое разложение:
- 21. Алюминий – переходный металл.Соединения алюминия – амфотерны.
- 22. Химические свойства алюминия (Al)Взаимодействие с водой
- 23. В электрохимическом ряду металлов алюминий следует за
- 24. Слайд 24
- 25. Т е с т Как называется вещество,
- 26. Т е с т 2. Выберите свойство, не относящееся к физическим свойствам алюминия.ЛегкоплавкостьВысокая электропроводностьХрупкостьНаличие блеска
- 27. Т е с т 3. Какое уравнение
- 28. Т е с т 4. Какое вещество
- 29. Т е с т 5. Вставьте пропущенное
- 30. Проверь себя!1 – 2 2 –
- 31. Цель :узнать…понять…научиться…
- 32. Домашнее задание:Изучить § 53 (82), выучить таблицуУпр.
- 33. Спасибо за работу!!!
Ложка
Слайд 10В электрохимическом ряду металлов алюминий следует за металлами II А группы,
то есть он очень активен. Объясните, почему же провода линий электропередач изготавливают из алюминия?
Слайд 11Алгоритм работы в группе
(Время работы – 10 минут)
Распределить роли в группе.
Выполнить
задание в соответствии с инструкцией.
Соблюдать правила техники безопасности.
Занести ответы в маршрутный лист.
Подвести итоги работы в группе.
.
Соблюдать правила техники безопасности.
Занести ответы в маршрутный лист.
Подвести итоги работы в группе.
.
Слайд 12Алюминий
Формула – Аl
Физические свойства:
металл серебристо-белого цвета;
твердый;
прочный;
легкий;
пластичный (вытягивается в тонкую проволоку
и прокатывается в фольгу);
обладает высокой электро- и теплопроводностью.
обладает высокой электро- и теплопроводностью.
Слайд 13Получение
алюминия (Al)
Алюминий в промышленности получают электролизом расплава оксида алюминия:
эл.ток
2Al2O3 ? 4 Al + 3O2
Слайд 14Химические свойства
алюминия (Al)
1. Взаимодействие с простыми веществами:
4Al + 3O2 =
2Al2O3
4Al+ 3C = Al4C3
2. Взаимодействие со сложными веществами:
с кислотами:
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
со щелочами:
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6]+3H2
Вывод: Алюминий взаимодействует
и с кислотой, и со щелочью
4Al+ 3C = Al4C3
2. Взаимодействие со сложными веществами:
с кислотами:
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
со щелочами:
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6]+3H2
Вывод: Алюминий взаимодействует
и с кислотой, и со щелочью
Слайд 15Оксид алюминия
Формула – Аl2O3
Физические свойства:
Белое кристаллическое вещество,
тугоплавкое,
твердое
Слайд 16Получение
оксида алюминия (Аl2O3)
Термическое разложение гидроксида алюминия
t
2Al(OH)3 = Al2О3 + 3Н2О
Окисление
4Al + 3O2 = 2Al2О3
2Al(OH)3 = Al2О3 + 3Н2О
Окисление
4Al + 3O2 = 2Al2О3
Слайд 17Химические свойства
оксида алюминия (Al2О3)
1. Взаимодействие с кислотами:
Al2O3 + 6HCl =
2AlCl3 + 3H2O
2. Взаимодействие со щелочами:
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Вывод: оксид алюминия взаимодействует
и с кислотой, и со щелочью
2. Взаимодействие со щелочами:
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Вывод: оксид алюминия взаимодействует
и с кислотой, и со щелочью
Слайд 18Гидроксид алюминия
Формула – Аl(OH)3
Физические свойства:
Белое студенистое,
полимерное вещество,
плохо растворимое
в воде
Слайд 19Получение
гидроксида алюминия (Аl(OН)3)
Получают при взаимодействии солей алюминия с водными растворами
щёлочи:
AlCl3 +3NaOH=Al(OH)3 +3NaCl
AlCl3 +3NaOH=Al(OH)3 +3NaCl
Слайд 20Химические свойства
гидроксида алюминия (Al(ОН)3)
1.Термическое разложение:
t
Al(OH)3 = Al2O3 + H2O
2.Взаимодействие с кислотами:
2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O
3.Взаимодействие с щелочами:
Al(OH)3 + NaOHизб. = Na[Al(OH)4]
Тетрагидроксо-
алюминат натрия
Вывод: гидроксид алюминия взаимодействует
и с кислотой, и со щелочью
Al(OH)3 = Al2O3 + H2O
2.Взаимодействие с кислотами:
2Al(OH)3 + 6HCl = 2AlCl3 + 6H2O
3.Взаимодействие с щелочами:
Al(OH)3 + NaOHизб. = Na[Al(OH)4]
Тетрагидроксо-
алюминат натрия
Вывод: гидроксид алюминия взаимодействует
и с кислотой, и со щелочью
Слайд 21Алюминий – переходный металл.
Соединения алюминия – амфотерны.
Амфотерность – это способность
химических соединений проявлять в зависимости от условий как кислотные, так и основные свойства.
Слайд 22Химические свойства
алюминия (Al)
Взаимодействие с водой при обычных условий:
Al + H2
O =
Взаимодействие с водой при удалении оксидной пленки:
Al + Н2О =
Взаимодействие с водой при удалении оксидной пленки:
Al + Н2О =
не взаимодействует
не взаимодействует
Слайд 23В электрохимическом ряду металлов алюминий следует за металлами II А группы,
то есть он очень активен. Объясните, почему же провода линий электропередач изготавливают из алюминия?
Слайд 25Т е с т
Как называется вещество, формула которого – Al2O3?
2)
2)
3)
3)
Алюминий
Оксид алюминия
Гидроксид алюминия
Слайд 26Т е с т
2. Выберите свойство, не относящееся к физическим
свойствам алюминия.
Легкоплавкость
Высокая электропроводность
Хрупкость
Наличие блеска
Легкоплавкость
Высокая электропроводность
Хрупкость
Наличие блеска
Слайд 27Т е с т
3. Какое уравнение химической реакции отражает образование
оксидной пленки на поверхности алюминия?
2Al(OH)3 = Al2O3 + 3H2O
4Al + 3O2 = 2Al2O3
Al2 O3+3H2SO4 =Al2 (SO4)3 + 3H2 O
2Al(OH)3 = Al2O3 + 3H2O
4Al + 3O2 = 2Al2O3
Al2 O3+3H2SO4 =Al2 (SO4)3 + 3H2 O
Слайд 28Т е с т
4. Какое вещество вступает во взаимодействие с
раствором серной кислоты?
(… + H2SO4р-р = Al2 (SO4)3 + H2)
1) 2)
3)
(… + H2SO4р-р = Al2 (SO4)3 + H2)
1) 2)
3)
Алюминий
Оксид алюминия
Гидроксид алюминия
Слайд 29Т е с т
5. Вставьте пропущенное слово:
Оксид
алюминия и гидроксид алюминия являются … веществами.
1) 2)
1) 2)
Амфотерными
Кислотными
Основными
3)
Слайд 30Проверь себя!
1 – 2
2 – 3
3 – 2
4
– 1
5 – 3
5 – 3
0 ошибок – «5»
1 ошибки – «4»
2 ошибки – «3»
> 3 ошибок – «2»
Слайд 32Домашнее задание:
Изучить § 53 (82), выучить таблицу
Упр. 3, после § 53
(82).
«Алюмен» означает «квасцы». Двойные соли алюминия использовались с глубокой древности. Их применяли в качестве протравы при крашении тканей (для более прочного связывания краски), для обработки древесины. Македонский царь Архелай приказал обмазать деревянные стены квасцами. Какие качества придает древесине двойная соль алюминия. Знаете ли вы современное использование квасцов?
«Алюмен» означает «квасцы». Двойные соли алюминия использовались с глубокой древности. Их применяли в качестве протравы при крашении тканей (для более прочного связывания краски), для обработки древесины. Македонский царь Архелай приказал обмазать деревянные стены квасцами. Какие качества придает древесине двойная соль алюминия. Знаете ли вы современное использование квасцов?