- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 9 класс по теме: Аммиак. Физические и химические свой¬ства. Получение и применение.
Содержание
- 1. Презентация по химии 9 класс по теме: Аммиак. Физические и химические свой¬ства. Получение и применение.
- 2. Вычислите относительную плотность азота и аммиака по: водороду, воздуху, кислороду. Решите задачи
- 3. Осуществить цепочку превращений: азот -> аммиак ->
- 4. О каком веществе идет речь?Пары этого вещества
- 5. Слайд 5
- 6. Аммиак. Физические и химические свойства. Получение и
- 7. ИСТОРИЧЕСКАЯ СПРАВКАПолучен в 1774 г. англ. химиком
- 8. Слайд 8
- 9. ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА газ без цвета
- 10. ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА (связанные с изменениями
- 11. ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА (связанные с особенностями
- 12. ПОЛУЧЕНИЕ АММИАКА: 1. в лаборатории используют действие
- 13. Слайд 13
- 14. ЗакреплениеВ результате разложения 53,5г аммоний хлорида выделилось
- 15. Рефлексия1. Формула молекулы аммиакаА. NH4 Б. NH4Cl В. NH32.
Слайд 1Как распознать газы:
Кислород, углекислый газ и азот?
К 250 г раствора, содержащего 02 массовой доли гидроксида натрия, прилили азотной кислоты. Вычислите массу соли которая образовалась?
Слайд 2Вычислите относительную плотность азота и аммиака по: водороду, воздуху, кислороду.
Решите
Слайд 3Осуществить цепочку превращений:
азот -> аммиак -> оксид азота( II )
Слайд 4О каком веществе идет речь?
Пары этого вещества способны изменять окраску цветов.
Некоторые цветы, которые изначально не имеют запаха, после обработки этим веществом начинают благоухать. Например, невероятно нежный аромат приобретают астры.
Слайд 6Аммиак. Физические и химические свойства. Получение и применение
Урок №31
Слайд 7ИСТОРИЧЕСКАЯ СПРАВКА
Получен в 1774 г. англ. химиком Джозефом Пристли.
В 1784
в 1787г. получил официальное название «аммониак» – от латинского названия нашатыря – sal ammoniac; эту соль получали близ храма бога Амона в Египте.
В обиход в вёл название аммиак 1801г. русский химик Яков Дмитриевич Захаров
Джозеф Пристли
Клод Луи Бертолле
Слайд 9ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА
газ
без цвета
имеет резкий запах
едкий
в 1,7 раза легче воздуха
при Т = -33,40 С сжижается
при Т = - 77,70 С затвердевает
растворяется в спиртах, бензоле, ацетоне
хорошо растворим в воде (в 1 V воды – 700 V аммиака)
Растворимость аммиака в воде
Н2О
NHз
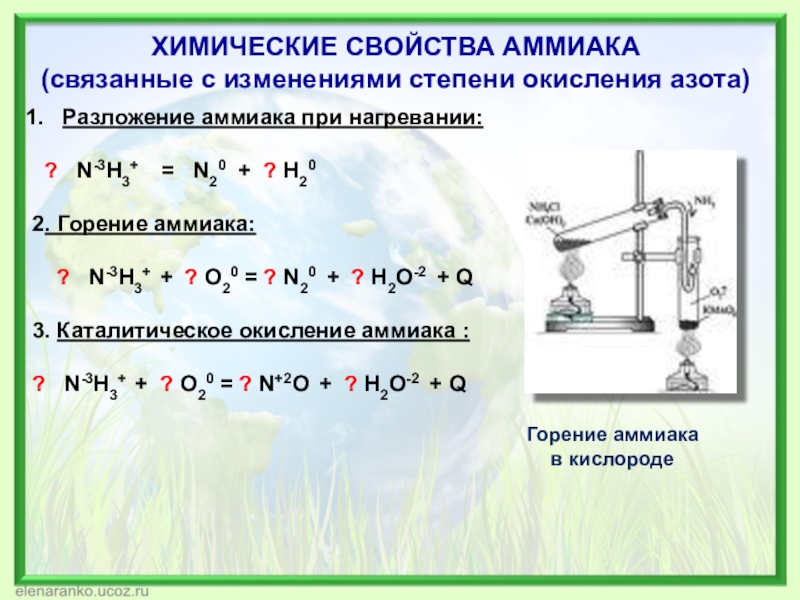
Слайд 10ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
(связанные с изменениями степени окисления азота)
Разложение аммиака при
? N-3H3+ = N20 + ? H20
2. Горение аммиака:
? N-3H3+ + ? О20 = ? N20 + ? H2O-2 + Q
3. Каталитическое окисление аммиака :
? N-3H3+ + ? О20 = ? N+2O + ? H2O-2 + Q
Горение аммиака
в кислороде
Задание: составьте электронный баланс,
укажите окислитель/восстановитель, процесс окисление /восстановитель
NH4Cl, Ca(OH)2
KMnO4
O2
NHз
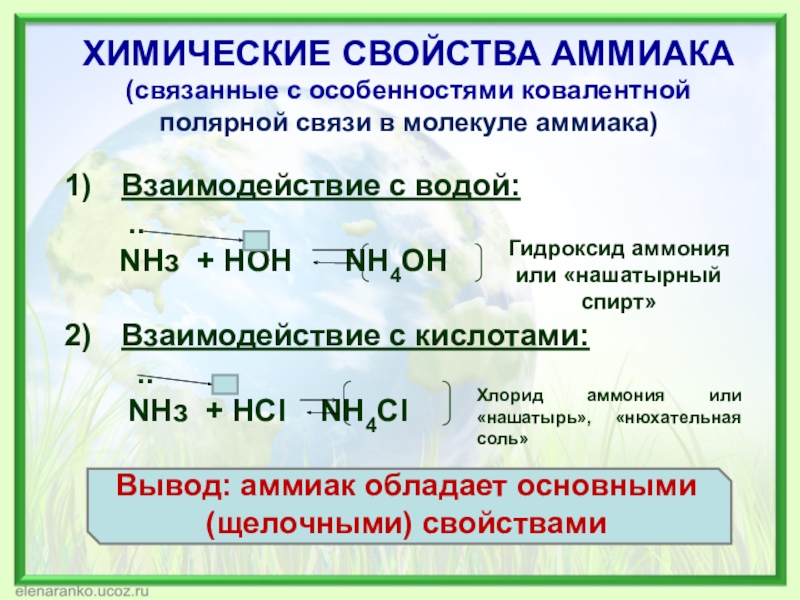
Слайд 11ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА (связанные с особенностями ковалентной полярной связи в молекуле
Взаимодействие с водой:
..
NHз + HOH NH4OH
Взаимодействие с кислотами:
..
NHз + HCl NH4Cl
Гидроксид аммония или «нашатырный спирт»
Хлорид аммония или «нашатырь», «нюхательная соль»
Вывод: аммиак обладает основными (щелочными) свойствами
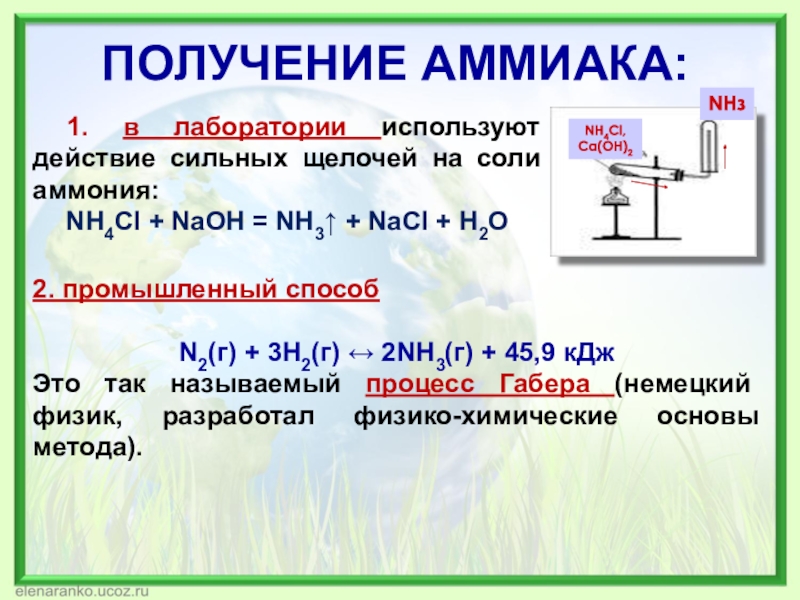
Слайд 12ПОЛУЧЕНИЕ АММИАКА:
1. в лаборатории используют действие сильных щелочей на соли
NH4Cl + NaOH = NH3↑ + NaCl + H2O
2. промышленный способ
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
NH4Cl, Ca(OH)2
NHз
Задание:определите тип реакции; определите куда сместится равновесие при повыш. Температуры и пониж. давления
Слайд 14Закрепление
В результате разложения 53,5г аммоний хлорида выделилось 15 г аммиака. Определите
(Ответ: 88%)
Слайд 15Рефлексия
1. Формула молекулы аммиака
А. NH4 Б. NH4Cl В. NH3
2. Степень окисления азота в
А. +3 Б. +5 В. -3
3. Формула иона аммония
А. NH4+ Б. NH4- В. NH3+
4. Связь между атомами водорода одной молекулы и атомами сильно электроотрицательного элемента (фтора, кислорода, азота) другой молекулы, называется:
А. ковалентной Б. водородной В. ионной
5. Верны ли суждения?
.1. аммиак – бесцветный газ с резким запахом, хорошо растворим в воде
.2. 10%-ный водный раствор аммиака называется нашатырный спирт
А. верно только 1.
Б. верно только .2.
В. оба суждения верны Г. оба суждения не верны