- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 11 класс по теме : Летучие водородные соединения
Содержание
- 1. Презентация по химии 11 класс по теме : Летучие водородные соединения
- 2. ПЛАН УРОКАОпрос домашнего задания:-тестирование;- фронтальная беседа по
- 3. ЦЕЛЬ УРОКА:Обобщить и углубить знания о летучих
- 4. Слайд 4
- 5. Слайд 5
- 6. Слайд 6
- 7. ВОПРОС. КАКОЙ ВИД ХИМИЧЕСКОЙ СВЯЗИ ПРИСУТСТВУЕТ В
- 8. ВОПРОС. КАК ИЗМЕНЯЕТСЯ ПОЛЯРНОСТЬ СВЯЗИ В ПЕРИОДАХ?
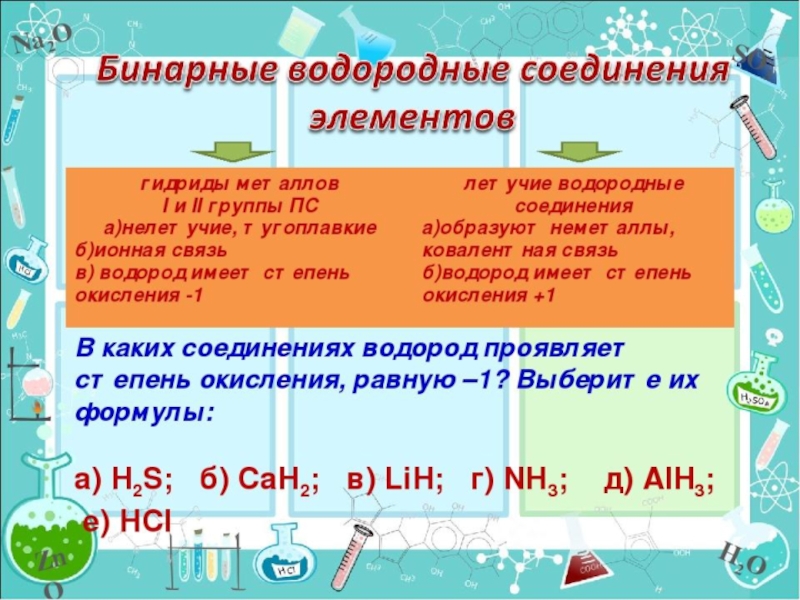
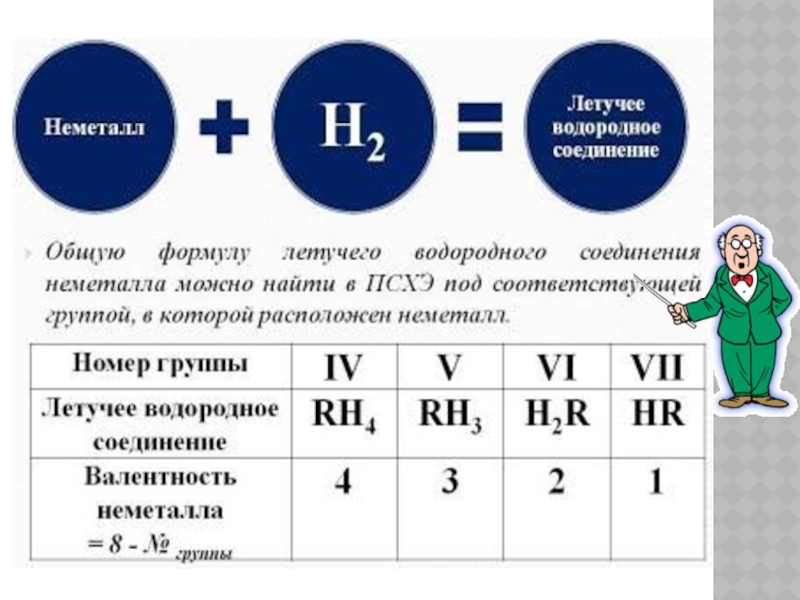
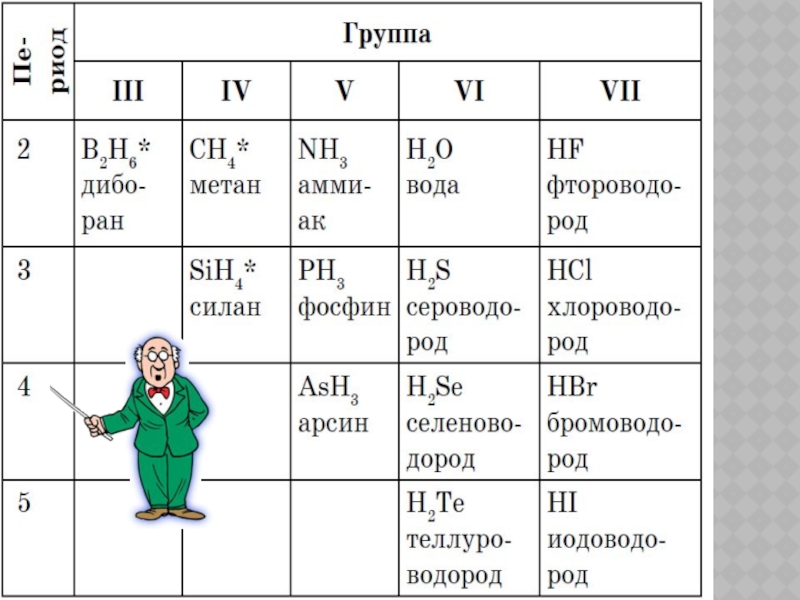
- 9. СОСТАВ И СТРОЕНИЕ ВОДОРОДНЫХ СОЕДИНЕНИЙ НЕМЕТАЛЛОВ RH4,
- 10. ПРИМЕРПример: водородные соединения III периода расположены в порядке усиления полярной связи:Усиление полярности связи
- 11. ПРИМЕРВодородные соединения VII группы, главной подгруппы в порядке усиления полярности связи:Усиление полярности связи
- 12. ОТВЕТИМ НА ВОПРОСЫВопрос. Влияет ли полярность связи
- 13. ВОПРОС. КАКИЕ СОЕДИНЕНИЯ ОБРАЗУЮТСЯ ПРИ РАСТВОРЕНИИ ВОДОРОДНЫХ
- 14. ВОПРОСВопрос. Как изменяется кислотно-основной характер водородных соединений
- 15. ПРИМЕР:водородные соединения VII группы главной подгруппы HF, НСl,
- 16. ВЫВОД: В периодах и группах, главных подгруппах
- 17. Пример: Следует отметить, что водородные соединения
- 18. ХИМИЧЕСКИЕ СВОЙСТВА.а) Взаимодействие с водой – диссоциация
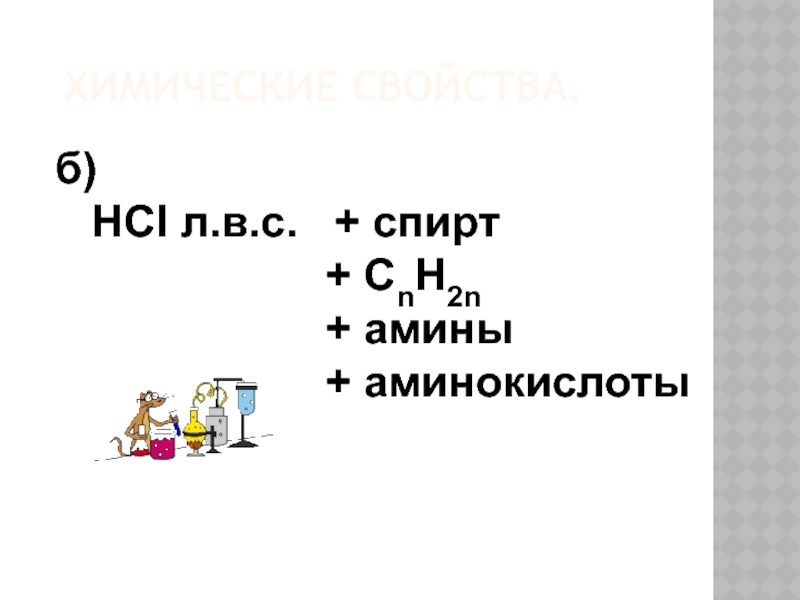
- 19. ХИМИЧЕСКИЕ СВОЙСТВА. б) HCI л.в.с.
- 20. ХИМИЧЕСКИЕ СВОЙСТВА.в) HCI водный раствор
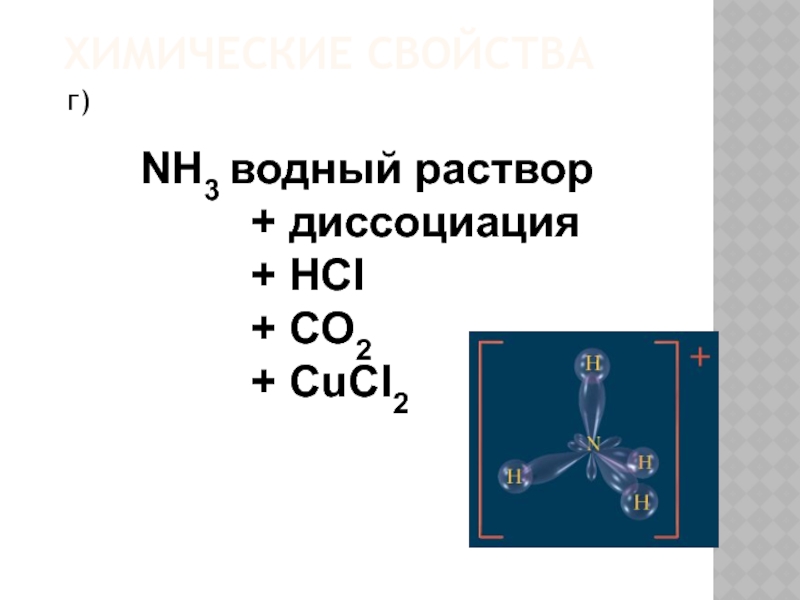
- 21. ХИМИЧЕСКИЕ СВОЙСТВАг) NH3 водный раствор
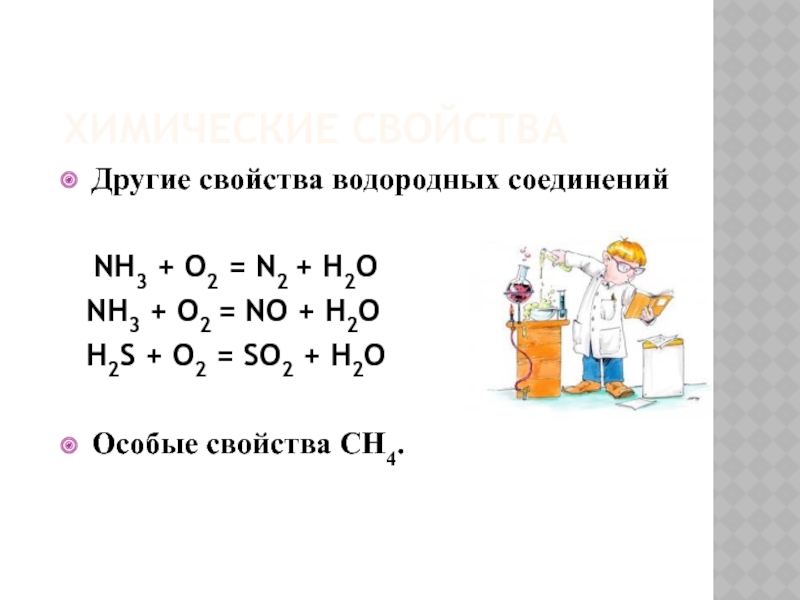
- 22. ХИМИЧЕСКИЕ СВОЙСТВАДругие свойства водородных соединений
- 23. Слайд 23
- 24. ПОЛУЧЕНИЕ ВОДОРОДНЫХ СОЕДИНЕНИЙ НЕМЕТАЛЛОВа) Синтез.
- 25. ЗАПИШИТЕ УРАВНЕНИЯ РЕАКЦИЙ ПОЛУЧЕНИЯ МЕТАНА ИЗ КАРБИДА
- 26. ПРОВЕРКАAl4 C3 + 12 H2 O
- 27. ВСТАВЬ ПРОПУЩЕННЫЕ СЛОВАЛетучие водродные соединения неметаллов имеют
- 28. ВСТАВЬ ПРОПУЩЕННЫЕ СЛОВАсила кислот, образованных атомами неметаллов
- 29. ПРОВЕРКАЛетучие водродные соединения неметаллов имеют молекулярные решётки.
- 30. СПАСИБО ЗА УРОК!Домашнее задание: §40, № 2,3, Подготовиться к самостоятельной работе по теме.
- 31. Слайд 31
Слайд 1УРОК ХИМИИ
11 КЛАСС
Летучие водородные соединения неметаллов
Автор :учитель биологии и химии
Слайд 2ПЛАН УРОКА
Опрос домашнего задания:
-тестирование;
- фронтальная беседа по вопросам.
Изучение нового материала:
- состав
- строение летучих соединений неметаллов;
- свойства водородных соединений;
- получение водородных соединений.
Слайд 3ЦЕЛЬ УРОКА:
Обобщить и углубить знания о летучих водородных соединениях неметаллов.
Задачи:
Уметь определять
Определять тип связи, вид кристаллической решетки.
Описывать свойства соединений и способы получения.
Слайд 7ВОПРОС. КАКОЙ ВИД ХИМИЧЕСКОЙ СВЯЗИ ПРИСУТСТВУЕТ В ВОДОРОДНЫХ СОЕДИНЕНИЯХ? КАКОЙ ТИП
Ответ: В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решетку.
Полярность связи зависит от разности и ЭО — чем она больше, тем полярнее связь.
Слайд 8ВОПРОС. КАК ИЗМЕНЯЕТСЯ ПОЛЯРНОСТЬ СВЯЗИ В ПЕРИОДАХ? В ГРУППАХ, ГЛАВНЫХ ПОДГРУППАХ?
Ответ:
Слайд 9СОСТАВ И СТРОЕНИЕ ВОДОРОДНЫХ СОЕДИНЕНИЙ НЕМЕТАЛЛОВ
RH4, RH3, RH2, RH
В
растворов л.в.с. увеличиваются.
В группах кислотные свойства водных
растворов тоже увеличиваются.
Слайд 10ПРИМЕР
Пример: водородные соединения III периода расположены в порядке усиления полярной связи:
Усиление
Слайд 11ПРИМЕР
Водородные соединения VII группы, главной подгруппы в порядке усиления полярности связи:
Усиление
Слайд 12ОТВЕТИМ НА ВОПРОСЫ
Вопрос. Влияет ли полярность связи на растворимость водородного соединения
Ответ: Влияет, т.к. молекулы воды сильно полярны, и чем полярнее молекула, тем более сильное возникает межмолекулярное взаимопритяжение с образованием водородных связей.
Слайд 13ВОПРОС. КАКИЕ СОЕДИНЕНИЯ ОБРАЗУЮТСЯ ПРИ РАСТВОРЕНИИ ВОДОРОДНЫХ СОЕДИНЕНИЙ III ПЕРИОДА В
Ответ:
При растворении в воде не наблюдается проявления кислотноосновного характера у SiH4, он сразу сгорает в кислороде; РН3 — дает очень слабую основную реакцию; H2S— дает слабокислую реакцию; НСl — сильнокислую реакцию, т. к. от SiH4 до НСl радиус иона неметалла уменьшается, а заряд — возрастает, полярность связи в молекулах возрастает, все это вызывает усиление кислотного характера.
К концу периода усиливается кислотный характер водородного соединения.
Слайд 14ВОПРОС
Вопрос. Как изменяется кислотно-основной характер водородных соединений неметаллов в группах главных
Ответ: Кислотно-основные свойства водородных соединений неметаллов одной подгруппы отличаются. Прочность связи Н—Э уменьшается, т. к. увеличивается длина связи.
Слайд 15ПРИМЕР:
водородные соединения VII группы главной подгруппы HF, НСl, НВr, HI; НСl, НВr, HI — это
Слайд 16ВЫВОД:
В периодах и группах, главных подгруппах с увеличением заряда ядер
Слайд 17Пример:
Следует отметить, что водородные соединения в ОВР всегда проявляют восстановительные
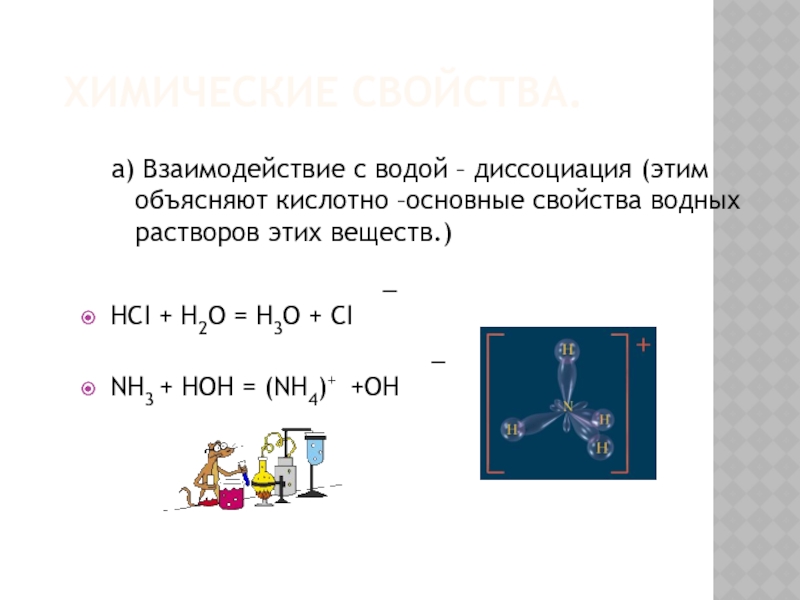
Слайд 18ХИМИЧЕСКИЕ СВОЙСТВА.
а) Взаимодействие с водой – диссоциация (этим объясняют кислотно –основные
_
HCI + H2O = H3O + CI
_
NH3 + HOH = (NH4)+ +OH
Слайд 20ХИМИЧЕСКИЕ СВОЙСТВА.
в)
HCI водный раствор
+ Ме (до Н)
+ МеО
+ Ме (ОН)n
+ соль
+ -
H CI
Слайд 22ХИМИЧЕСКИЕ СВОЙСТВА
Другие свойства водородных соединений
NH3 + O2 =
NH3 + O2 = NO + H2O
H2S + O2 = SO2 + H2O
Особые свойства CH4.
Слайд 24ПОЛУЧЕНИЕ ВОДОРОДНЫХ СОЕДИНЕНИЙ НЕМЕТАЛЛОВ
а) Синтез.
H2 + CI2 =
N2 + 3H2 = 2NH3 + Q
2H2 + O2 = 2H2O + Q
C + 2H2 = CH4 + Q
б) Лабораторный способ.
1. 2NH4OH + Ca(OH)2 = 2NH4OH + CaCI2
NH4OH = NH3 + H2O
2. Na CI + конц. H2SO4 = NaHSO4 + HCI
Слайд 25ЗАПИШИТЕ УРАВНЕНИЯ РЕАКЦИЙ ПОЛУЧЕНИЯ МЕТАНА ИЗ КАРБИДА АЛЮМИНИЯ , СИЛАНА –
Al4 C3 + H2 O =
Mg2 Si + HCl =
Ca3 N2 + H2 O =
Al 2 S 3 + HCl =
Слайд 26ПРОВЕРКА
Al4 C3 + 12 H2 O = 4 Al(OH)3 +
Mg2 Si + 4 HCl = 2 MgCl2 + SiH4
Ca3 N2 + 6 H2 O = 3 Ca(OH)2 + 2NH3
Al 2 S 3 + 12 HCl = 2 AlCl 3 + 3H 2S
Слайд 27ВСТАВЬ ПРОПУЩЕННЫЕ СЛОВА
Летучие водродные соединения неметаллов имеют _____________решётки. В периодах слева
HF + H2O = __________ Это связано с тем, что атом кислорода имеет ______________пару электронов, а атом водорода - _______орбиталь. Образуется _____________связь между водородом и кислородом, в то время как неметалл, лишённый атома водорода проявляет окислительные свойства.
У аммиака по другому -атом азота имеет ____________электронную пару и забирает у молекулы воды атом водорода, у которого есть _____________орбиталь(_________________связь).
NH3 + H2O =___________ - то есть аммиак, растворенный в воде обладает ____________свойствами.
сила кислот, образованных атомами неметаллов седьмой группы(HF, HCl, HBr, HI) увеличивается не снизу вверх, а сверху вниз(HF - самая слабая из таких кислот). Это происходит из-за того, что самый электроотрицательный атом фтора притягивает к себе ионы водорода, поэтому степень диссоциации фтороводорода в воде меньше, чем у HClПодробнее - на Znanija.com - https://znanija.com/task/1310709#readmore