- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по биологии Химические реакции
Содержание
- 1. Презентация по биологии Химические реакции
- 2. Цели урока: обобщить представления о химической реакции
- 3. Химическая реакция (или химическое явление) –
- 4. Типы химических реакцийПо числу и составу исходных
- 5. По числу и составу исходных веществ и продуктов реакции
- 6. По тепловому эффектуЭкзотермические реакции -протекают с выделением
- 7. Слайд 7
- 8. По признаку обратимостиНеобратимые реакции - протекают только
- 9. По признаку изменения степени окисленияОкислительно – восстановительные
- 10. По агрегатному состоянию веществ1) Гетерогенные реакции -
- 11. По наличию катализатора1) Каталитические реакции - протекают
- 12. Домашнее задание Закончите уравнения химических реакций и
- 13. ЗакреплениеСделать характеристику для химического уравнения по признакам
- 14. Слайд 14
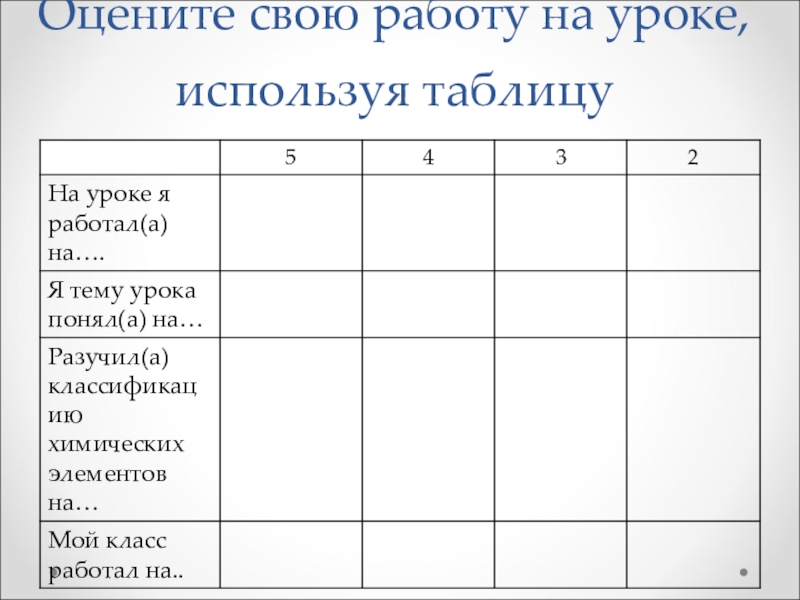
- 15. Оцените свою работу на уроке, используя таблицу
Цели урока: обобщить представления о химической реакции как о процессе превращения одного или нескольких веществ в другие вещества;рассмотреть классификацию химических реакций и научить обучающихся применять ее при характеристике химических реакций в неорганической химии.
Слайд 2Цели урока:
обобщить представления о химической реакции как о процессе превращения
одного или нескольких веществ в другие вещества;
рассмотреть классификацию химических реакций и научить обучающихся применять ее при характеристике химических реакций в неорганической химии.
рассмотреть классификацию химических реакций и научить обучающихся применять ее при характеристике химических реакций в неорганической химии.
Слайд 3
Химическая реакция (или химическое явление) – это процесс, в результате
которого из одних веществ образуются другие вещества, отличающиеся от исходных по составу или строению, а следовательно, и по свойствам.
Например: ,
где - оксид кальция (II),
- гидроксид кальция (II)
Например: ,
где - оксид кальция (II),
- гидроксид кальция (II)
Слайд 4Типы химических реакций
По числу и составу исходных веществ и продуктов реакции
По
тепловому эффекту
По признаку обратимости
По признаку изменения степеней окисления
По агрегатному состоянию веществ
По наличию катализатора
По признаку обратимости
По признаку изменения степеней окисления
По агрегатному состоянию веществ
По наличию катализатора
Слайд 6По тепловому эффекту
Экзотермические реакции -протекают с выделением теплоты
С + O2 =
СO2 + Q
где СO2 - оксид углерода (IV)
где СO2 - оксид углерода (IV)
Эндотермические реакции -протекают с поглощением теплоты
N2 + O2 = 2NO – Q
где NO - оксид азота (II)
Слайд 8По признаку обратимости
Необратимые реакции - протекают только в одном направлении
Признаки необратимости:
образование осадка или слабого электролита (Н2О), выделение газа, выделение большого количества теплоты
где - серная кислота
- хлорид бария
- сульфат бария (белый осадок)
где - серная кислота
- хлорид бария
- сульфат бария (белый осадок)
Обратимые реакции -протекают одновременно в двух противоположных направлениях
где - аммиак
Слайд 9По признаку изменения степени окисления
Окислительно – восстановительные реакции:
1) протекают с изменением
степени окисления
где - хлорид железа (II)
2) протекают без изменения степени окисления элементов
где - оксид серы (VI)
- серная кислота
где - хлорид железа (II)
2) протекают без изменения степени окисления элементов
где - оксид серы (VI)
- серная кислота
Слайд 10По агрегатному состоянию веществ
1) Гетерогенные реакции - протекают в неоднородной среде,
на поверхности раздела фаз (т-г, т-ж, ж-г, т-т)
где - сульфат меди
- сульфат железа (II)
2) Гомогенные реакции - протекают между веществами в однородной среде, где нет поверхности раздела фаз
H2 (г)+ Cl2 (г) = 2HCl (г)
где HCl – соляная кислота
где - сульфат меди
- сульфат железа (II)
2) Гомогенные реакции - протекают между веществами в однородной среде, где нет поверхности раздела фаз
H2 (г)+ Cl2 (г) = 2HCl (г)
где HCl – соляная кислота
Слайд 11По наличию катализатора
1) Каталитические реакции - протекают с участием катализатора
где
- этиловый спирт
- этилен
2) Некаталитические реакции - протекают без участия катализатора
где MgO – оксид магния (II)
- этилен
2) Некаталитические реакции - протекают без участия катализатора
где MgO – оксид магния (II)
Слайд 12Домашнее задание
Закончите уравнения химических реакций и укажите их типы:
а) Al
+ Cl2 =
б) Mg + HCl =
в) NaOH + KCl =
г)
д)
б) Mg + HCl =
в) NaOH + KCl =
г)
д)
Слайд 13Закрепление
Сделать характеристику для химического уравнения по признакам классификации:
1. Реакция разложения
2. Реакция
ОВР, так как у элементов изменились степени окисления.
3. По тепловому эффекту – реакция эндотермическая.
4. Гетерогенная реакция
5. Необратимая реакция
3. По тепловому эффекту – реакция эндотермическая.
4. Гетерогенная реакция
5. Необратимая реакция