- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Первоначальные понятия химии (урок повторение )
Содержание
- 1. Презентация Первоначальные понятия химии (урок повторение )
- 2. Что такое химия?
- 3. ОпределениеХимия- наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения.
- 4. Основные понятия химииВеществоМолекулы и атомыХимический элементХимическая формулаВалентностьХимическое уравнениеМольОксид, кислота, основание, соль.РастворСтепень окисления
- 5. Вспомним строение атома
- 6. Атом- мельчайшая химически неделимая электронейтральная частица вещества.В
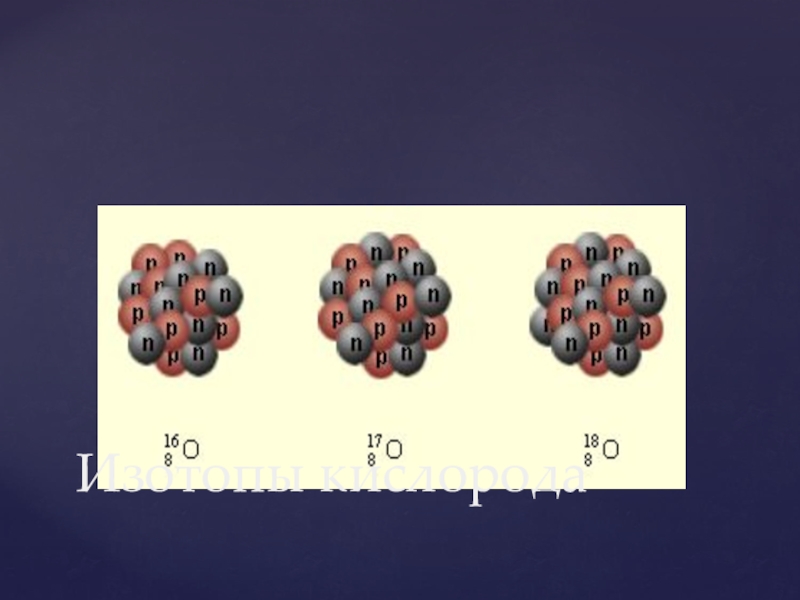
- 7. Изотопы кислорода
- 8. Изотопы отличаются друг от друга числом нейтронов
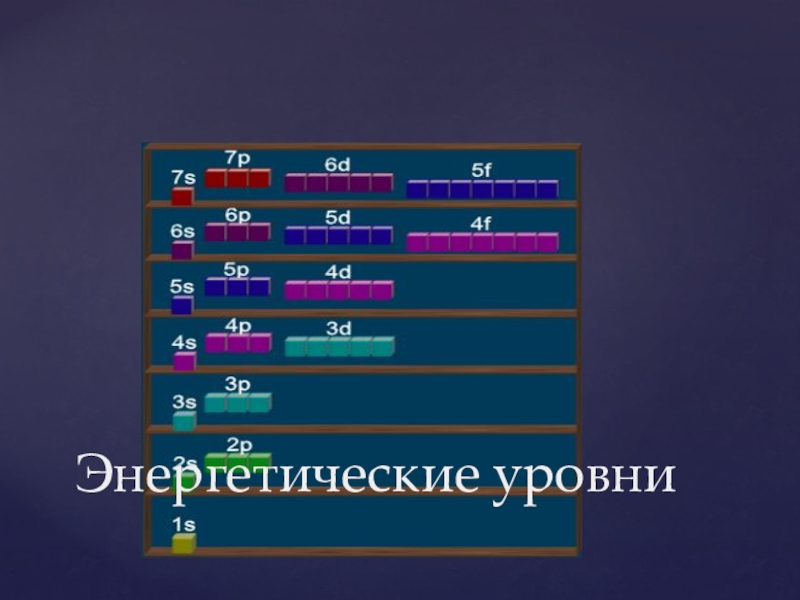
- 9. Энергетические уровни
- 10. Периодический закон Д.И. МенделееваСвойства химических элементов и
- 11. Периодическая система
- 12. Периодическая система Менделеева- графическое отображение периодического закона.В
- 13. Явления
- 14. Химические явления (химические реакции)
- 15. Химическая формула – это условная запись состава
- 16. Химическим уравнением называют условную запись химической реакции
- 17. Индикаторы Индикаторы – вещества, которые под действием
- 18. Классификация химических реакцийПо числу и составу исходных и образующихся веществ
- 19. Окислительно - восстановительныеКлассификация химических реакций
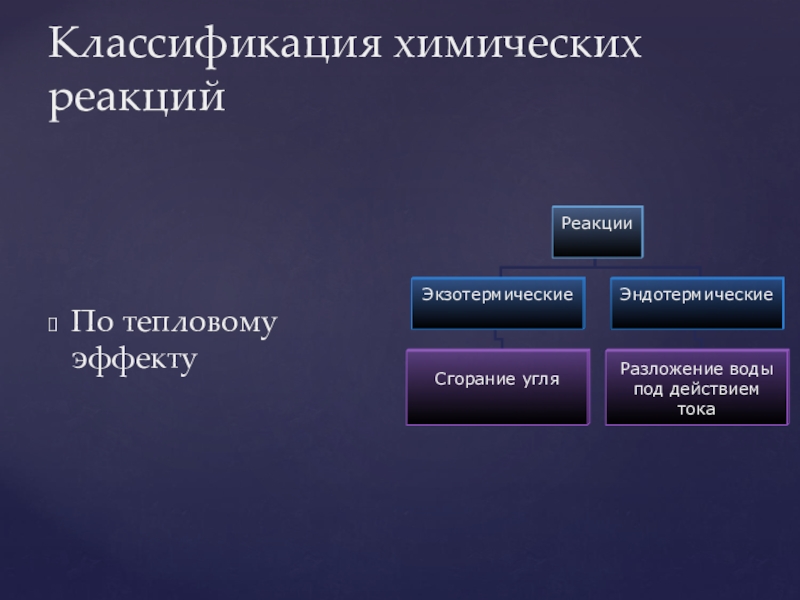
- 20. Классификация химических реакцийПо тепловому эффекту
- 21. По степени обратимости: обратимые и необратимые.Классификация химических реакций
- 22. Закон сохранения массы веществЗакон постоянства состава веществЗакон АвогадроПериодический законЗаконы химии
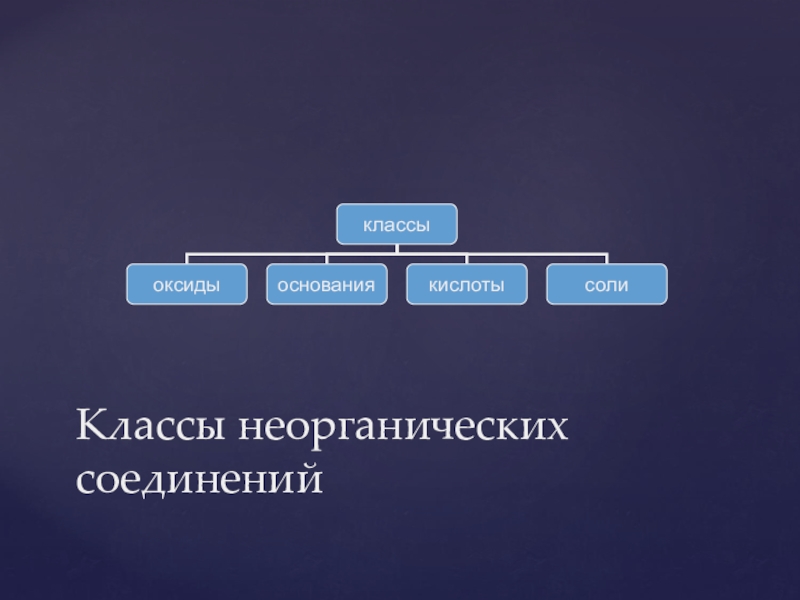
- 23. Классы неорганических соединений
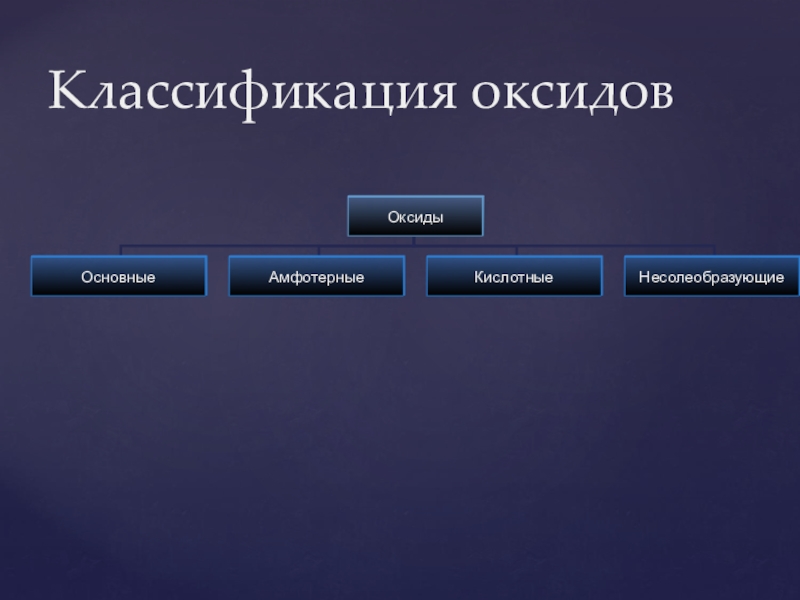
- 24. Классификация оксидов
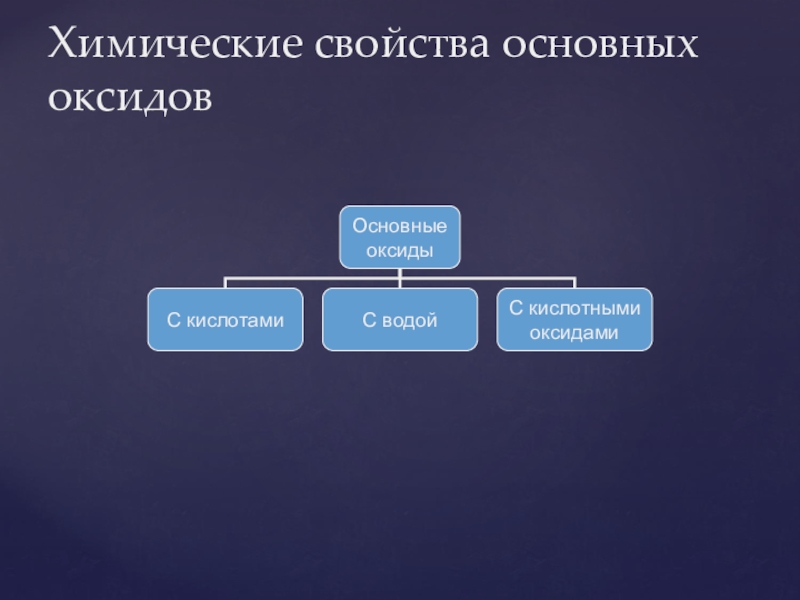
- 25. Химические свойства основных оксидов
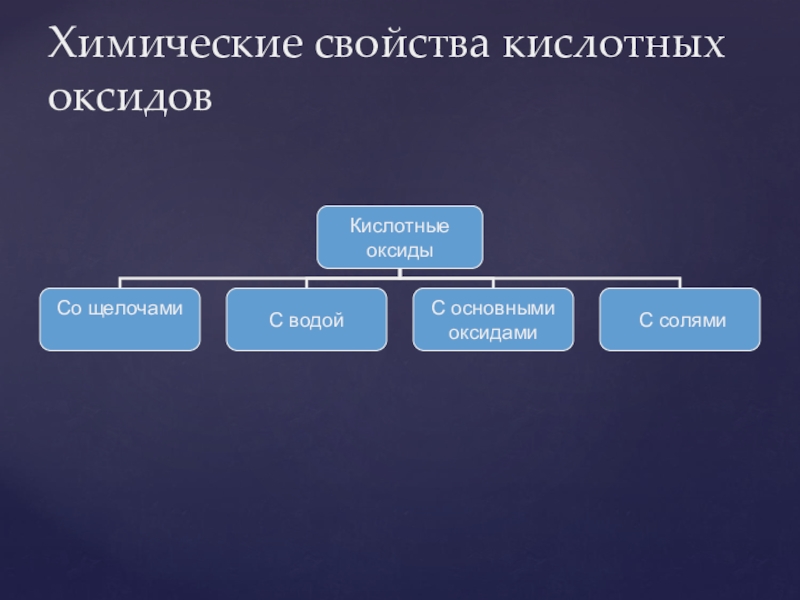
- 26. Химические свойства кислотных оксидов
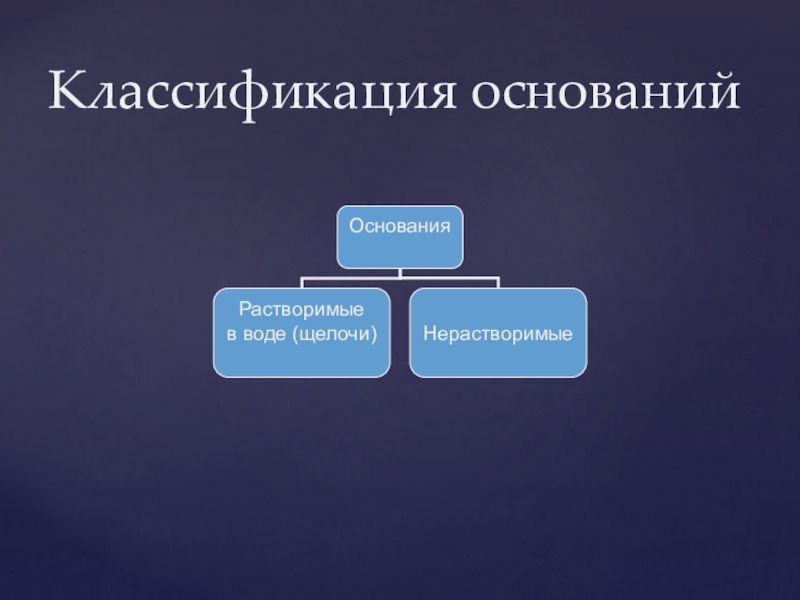
- 27. Классификация оснований
- 28. 1. Щелочь + кислота = соль +
- 29. Нераст. осн. + кислота = соль +
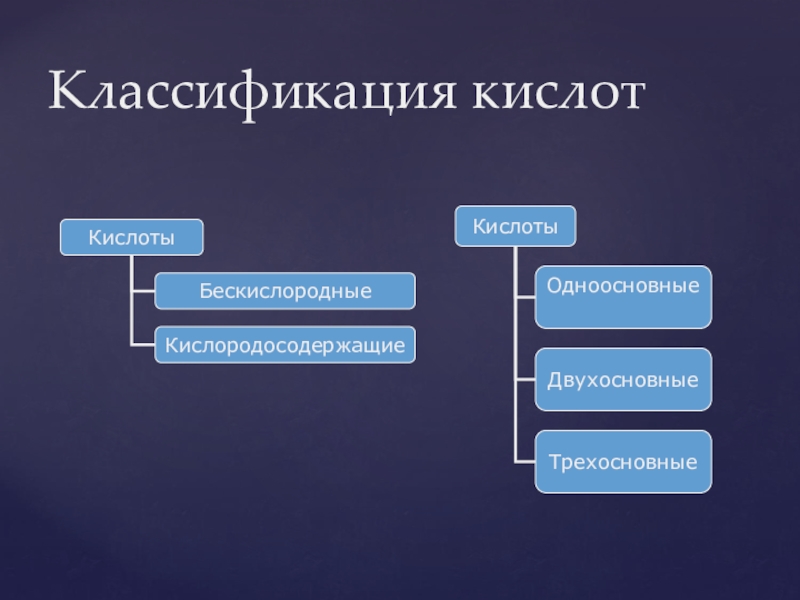
- 30. Классификация кислот
- 31. Изменяют цвет индикаторовС металламиС основными оксидамиС основаниямиС
- 32. Средние (нормальные) – К2СО3Кислые – КНСО3Основные – Mg(OH)CLДвойные – К2NaPO4Комплексные – Na2Zn(OH)4Классификация солей
- 33. Соль + кислота = другая соль+
- 34. Генетический ряд металлов 1.Металл- основный
- 35. Генетический ряд неметаллов Неметалл- кислотный оксид- кислота- сольГенетическая связь между классами неорганических соединений
- 36. Проверь свои знанияНапиши формулы веществ: карбонат калия,
- 37. Выберите названия групп, на которые делится заданный
- 38. Задания из ЕГЭ по химии
- 39. Задания из ЕГЭ по химии
- 40. Задания из ЕГЭ по химии
Слайд 3Определение
Химия- наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих
Слайд 4Основные понятия химии
Вещество
Молекулы и атомы
Химический элемент
Химическая формула
Валентность
Химическое уравнение
Моль
Оксид, кислота, основание, соль.
Раствор
Степень
Слайд 6Атом- мельчайшая химически неделимая электронейтральная частица вещества.
В центре атома находится положительно
Виды элементарных частиц: протоны (р), нейтроны (n), электроны (е).
Общее число протонов и нейтронов в ядре атома называют массовым числом (А). А= N + Р
Химический элемент- вид атомов с определенным зарядом ядра.
Изотопы- разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов в ядре, но разную массу.
Строение атома
Слайд 8Изотопы отличаются друг от друга числом нейтронов в ядре.
Порядковый номер
Номер периода показывает число энергетических уровней в атоме.
Номер группы- число электронов на последнем энергетическом уровне ( для элементов главных подгрупп).
Строение атома
Слайд 10Периодический закон Д.И. Менделеева
Свойства химических элементов и образуемых ими простых и
Слайд 12Периодическая система Менделеева- графическое отображение периодического закона.
В ней 7 периодов, 10
Каждый период начинается щелочными металлами и заканчивается инертными элементами.
В главных подгруппах (сверху вниз) с увеличением относительных атомных масс усиливаются металлические свойства элементов и ослабевают неметаллические.
Строение периодической системы
Слайд 15Химическая формула – это условная запись состава вещества посредством химических знаков
СаСО3 , Н2SO4 , СО2 , КОН
Химическая формула
Слайд 16Химическим уравнением называют условную запись химической реакции посредством химических знаков и
2Н2 + О2 = 2Н2О
Химическое уравнение
Слайд 17Индикаторы
Индикаторы – вещества, которые под действием растворов кислот и щелочей изменяют
Лакмус, метиловый оранжевый, фенолфталеин
Слайд 22Закон сохранения массы веществ
Закон постоянства состава веществ
Закон Авогадро
Периодический закон
Законы химии
Слайд 281. Щелочь + кислота = соль + вода
NaOH
2. Щелочь + кислотный оксид = соль + вода
2КОН + СО2 = К2СО3 + Н2О
3. Щелочь + соль1 = соль2 + основание
3NaOH + FeCL3 = 3NaCL + Fe(OH)3
Химические свойства щелочей
Слайд 29Нераст. осн. + кислота = соль + вода
Cu(OH)2 +
Нераст. осн. разлагаются при нагревании.
Сu(OH)2 = CuO + H2O
Химические свойства нерастворимых оснований
Слайд 31Изменяют цвет индикаторов
С металлами
С основными оксидами
С основаниями
С солями ( более слабых
Некоторые кислоты разлагаются при нагревании
Химические свойства кислот
Слайд 32Средние (нормальные) – К2СО3
Кислые – КНСО3
Основные – Mg(OH)CL
Двойные – К2NaPO4
Комплексные –
Классификация солей
Слайд 33 Соль + кислота = другая соль+ другая кислота
Соль + щелочь = другая соль + другое основание
СuSO4 +2 NaOH =Cu(OH)2 + Na2SO4
Соль1 + соль2 = соль3 + соль4
Cu(NO3)2 + Na2CO3 = CaCO3 +2NaNO3
Соль + металл = другая соль + другой металл
CuSO4 + Fe = Cu + FeSO4
Химические свойства солей
Слайд 34Генетический ряд металлов
1.Металл- основный оксид- основание (щелочь)- соль
2. Металл- основный оксид- соль- основание- основный оксид- металл
Cu- CuO- CuCL2- Cu(OH)2- CuO- Cu
Генетическая связь между классами неорганических соединений
Слайд 35Генетический ряд неметаллов
Неметалл- кислотный оксид- кислота- соль
Генетическая
Слайд 36Проверь свои знания
Напиши формулы веществ: карбонат калия, оксид натрия, серная кислота,
Слайд 37Выберите названия групп, на которые делится заданный класс, и соответствующие им
Названия групп Примеры
1. Кислородосодержащие а) Nа2О
2. Бескислородные б) NаОН
3. Кислотные в) FеСL3
4. Основные г) Р2О5
5. Средние д) Н3РО4
6. Одноосновные е) Н2S
7. Двухосновные ж) НСL
8. Трехосновные з) КНSО4
9. Кислые и) (СuОН)2СО3
10. Щелочи к) Fе(ОН)3
11. Нерастворимые основания
Проверь свои знания
Выберите названия групп, на которые делится заданный класс, и соответствующие им примеры.