Кутулик
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад открытого урока по химии на тему Спирты одноатомные и многоатомные
Содержание
- 1. Презентация открытого урока по химии на тему Спирты одноатомные и многоатомные
- 2. Цели урока: Изучить
- 3. План урока:Понятие «спирты», их состав и строение.Классификация
- 4. Спиртами называют производные углеводородов, в молекулах которых
- 5. Классификация спиртов 1. По числу гидроксильных групп
- 6. 2. По характеру радикалов, связанных с атомом
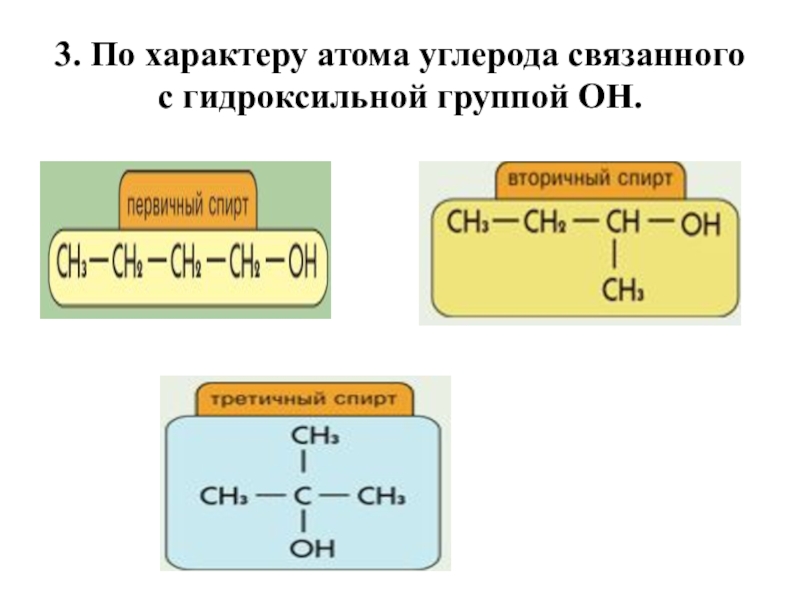
- 7. 3. По характеру атома углерода связанного с гидроксильной группой ОН.
- 8. Существование четвертичных спиртов невозможно,
- 9. Гомологический ряд.СnH2n+1OH; R-OH - общая
- 10. НоменклатураК названию углеводорода добавляют количество гидроксогрупп (префикс),
- 11. Изомерия Для алканолов характерно два вида
- 12. Физические свойства Следствием полярности связи О–Н и
- 13. Спирты от С1 до С11 по агрегатному
- 14. Одноатомный спирт - метанолЖидкость без цвета с
- 15. Одноатомный спирт - этанолБесцветная жидкость с характерным
- 16. Многоатомные спирты – этиленгликоль и глицеринБесцветные сиропообразные
- 17. Вредное воздействие этанола на организм человекаПри очень
- 18. Этиловый спирт является мощным наружным антисептиком и
- 19. Всем известно, что в этиловом спирте десятилетиями
- 20. При употреблении алкоголя мышление нарушается!Несовместимость между антисептическим
- 21. Этиловый спирт попадает во все органы и
- 22. Слайд 22
- 23. Очень часто алкоголь является причиной смертельных отравлений.
- 24. Применение спиртов Метанол CH3OH -производство формальдегида, муравьиной
- 25. Применение этиленгликоляВажным свойством этиленгликоля является способность понижать
- 26. Применение глицеринаПрименяется в производстве взрывчатых веществ нитроглицерина.При
- 27. Спасибо за внимание!
Цели урока: Изучить состав, строение, классификацию, номенклатуру, изомерию, физические свойства, применение спиртов и их влияние на организм человека.
Слайд 1Спирты одноатомные и многоатомные.
Преподаватель: Романова Евгения Валерьевна
ГАПОУ ИО «ЗАПТ» УПО п.
Слайд 2Цели урока:
Изучить состав, строение, классификацию, номенклатуру,
изомерию, физические свойства, применение спиртов и их влияние на организм человека.
Слайд 3План урока:
Понятие «спирты», их состав и строение.
Классификация спиртов по трем признакам.
Номенклатура спиртов.
Виды изомерии предельных одноатомных спиртов.
Физические свойства спиртов.
Биологическое действие этилового спирта на организм человека, применение спиртов.
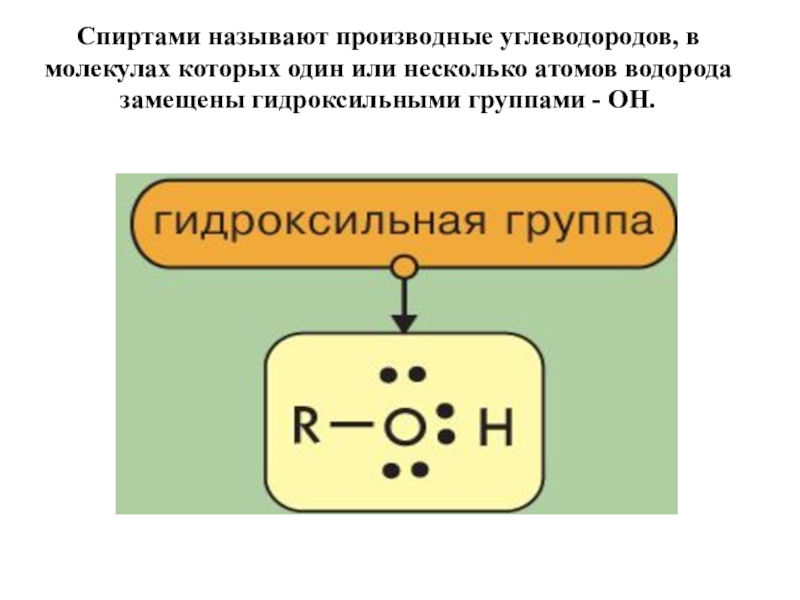
Слайд 4Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов
водорода замещены гидроксильными группами - ОН.
Слайд 5Классификация спиртов
1. По числу гидроксильных групп (атомность) спирты подразделяются на одноатомные
(одна группа -ОН) и многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов - полиолы (диолы, триолы ит.д).
Примеры:
двухатомный спирт – этиленгликоль (этандиол – 1,2)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH .
Современное название многоатомных спиртов - полиолы (диолы, триолы ит.д).
Примеры:
двухатомный спирт – этиленгликоль (этандиол – 1,2)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH .
Слайд 62. По характеру радикалов, связанных с атомом кислорода, различают
спирты:
предельные,
или алканолы (например, СH3CH2–OH) этиловый спирт.
непредельные, или алкенолы (CH2=CH–CH2–OH) аллиловый спирт.
Ароматические(C6H5CH2–OH). бензиловый спирт.
непредельные, или алкенолы (CH2=CH–CH2–OH) аллиловый спирт.
Ароматические(C6H5CH2–OH). бензиловый спирт.
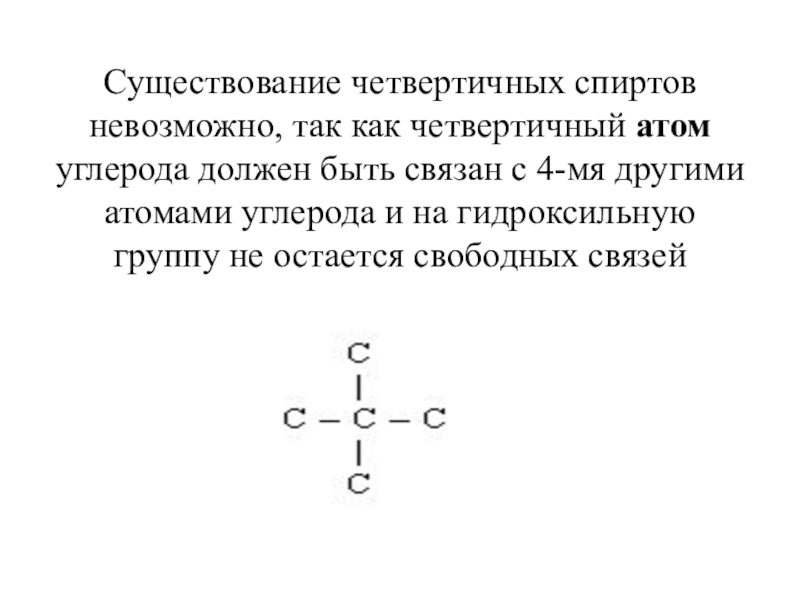
Слайд 8 Существование четвертичных спиртов невозможно, так как четвертичный атом углерода должен быть
связан с 4-мя другими атомами углерода и на гидроксильную группу не остается свободных связей
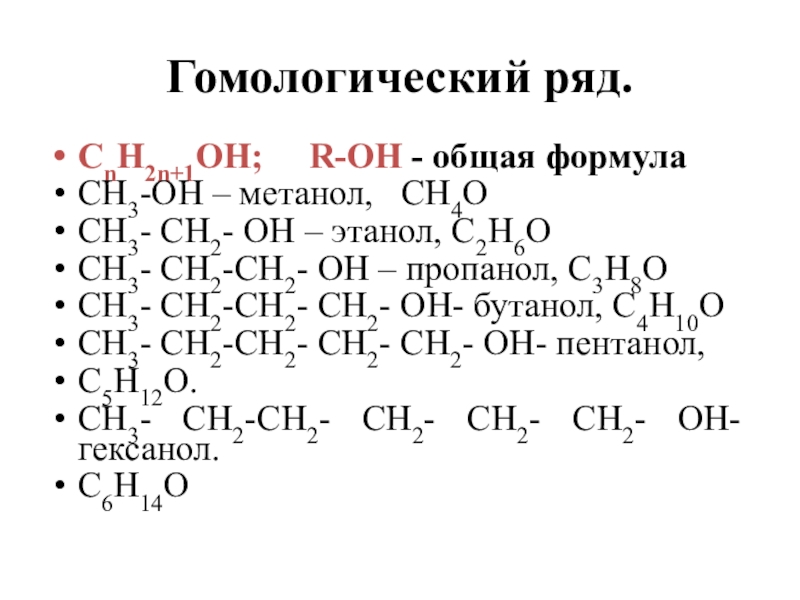
Слайд 9Гомологический ряд.
СnH2n+1OH; R-OH - общая формула
CH3-OH – метанол,
СH4O
СH3- CH2- OH – этанол, С2H6O
СH3- CH2-СH2- OH – пропанол, С3H8O
СH3- CH2-СH2- СH2- OH- бутанол, С4H10O
СH3- CH2-СH2- СH2- СH2- OH- пентанол,
С5H12O.
СH3- CH2-СH2- СH2- СH2- СH2- OH- гексанол.
С6H14O
СH3- CH2- OH – этанол, С2H6O
СH3- CH2-СH2- OH – пропанол, С3H8O
СH3- CH2-СH2- СH2- OH- бутанол, С4H10O
СH3- CH2-СH2- СH2- СH2- OH- пентанол,
С5H12O.
СH3- CH2-СH2- СH2- СH2- СH2- OH- гексанол.
С6H14O
Слайд 10Номенклатура
К названию углеводорода добавляют количество гидроксогрупп (префикс), затем – суффикс ОЛ,
затем указываются номера атомов углерода, с которыми соединены функциональные группы.
Название спирта = название УВ + (префикс) + - ОЛ + (n1, n2 ..., nn), где префикс обозначает число групп –ОН в молекуле: 2 – «ди», 3 – «три», 4 – «тетра» и т. д. n указывает положение гидроксильных групп в углеродной цепи.
Название спирта = название УВ + (префикс) + - ОЛ + (n1, n2 ..., nn), где префикс обозначает число групп –ОН в молекуле: 2 – «ди», 3 – «три», 4 – «тетра» и т. д. n указывает положение гидроксильных групп в углеродной цепи.
Слайд 11Изомерия
Для алканолов характерно два вида изомерии:
1. Изомерия углеродного скелета.
2. Изомерия
положения гидроксильной группы в углеродной цепи.
Первым из спиртов, для которых характерны оба вида изомерии, является бутанол.
Задание. Напишите три изомера вещества C4H9OH.
Первым из спиртов, для которых характерны оба вида изомерии, является бутанол.
Задание. Напишите три изомера вещества C4H9OH.
Слайд 12Физические свойства
Следствием полярности связи О–Н и наличия неподеленных пар электронов на
атоме кислорода является способность гидроксисоединений к образованию водородных связей
R R R
H O:- H+ O:- H+ O:
Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения (т.кип. метанола +64,7 С).
При испарении жидкости водородные связи между молекулами разрываются. Низшие спирты хорошо растворимы в воде. Поэтому молекулы спиртов образуют водородные связи с молекулами воды.
R R R
H O:- H+ O:- H+ O:
Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения (т.кип. метанола +64,7 С).
При испарении жидкости водородные связи между молекулами разрываются. Низшие спирты хорошо растворимы в воде. Поэтому молекулы спиртов образуют водородные связи с молекулами воды.
Слайд 13Спирты от С1 до С11 по агрегатному состоянию – жидкости, с
С12высшие спирты – твердые вещества.
В отличие от углеводородов спиртов нет в газообразном состоянии. Это связано с образованием водородных связей.
Спирты – растворители. С увеличением относительной молекулярной массы растворимость спиртов уменьшается. Твердые спирты в воде не растворимы.
Температура кипения спиртов выше чем у углеводородов.
В отличие от углеводородов спиртов нет в газообразном состоянии. Это связано с образованием водородных связей.
Спирты – растворители. С увеличением относительной молекулярной массы растворимость спиртов уменьшается. Твердые спирты в воде не растворимы.
Температура кипения спиртов выше чем у углеводородов.
Слайд 14Одноатомный спирт - метанол
Жидкость без цвета с температурой кипения +64,7С, характерным
запахом Легче воды. Горит чуть голубоватым пламенем.
Историческое название метанола – древесный спирт.
Метанол очень ядовит!
Историческое название метанола – древесный спирт.
Метанол очень ядовит!
Слайд 15Одноатомный спирт - этанол
Бесцветная жидкость с характерным запахом и жгучим вкусом,
температурой кипения+78,3С. Легче воды. Смешивается с ней в любых отношениях.
Легко воспламеняется, горит слабо светящимся голубоватым пламенем.
Историческое название этанола – винный спирт.
Легко воспламеняется, горит слабо светящимся голубоватым пламенем.
Историческое название этанола – винный спирт.
Слайд 16Многоатомные спирты – этиленгликоль и глицерин
Бесцветные сиропообразные жидкости сладковатого вкуса.
Они хорошо
растворяются в воде и в этаноле.
Этиленгликоль кипит при температуре +198С, а глицерин при +290С.
Этиленгликоль очень ядовитое вещество!
Этиленгликоль кипит при температуре +198С, а глицерин при +290С.
Этиленгликоль очень ядовитое вещество!
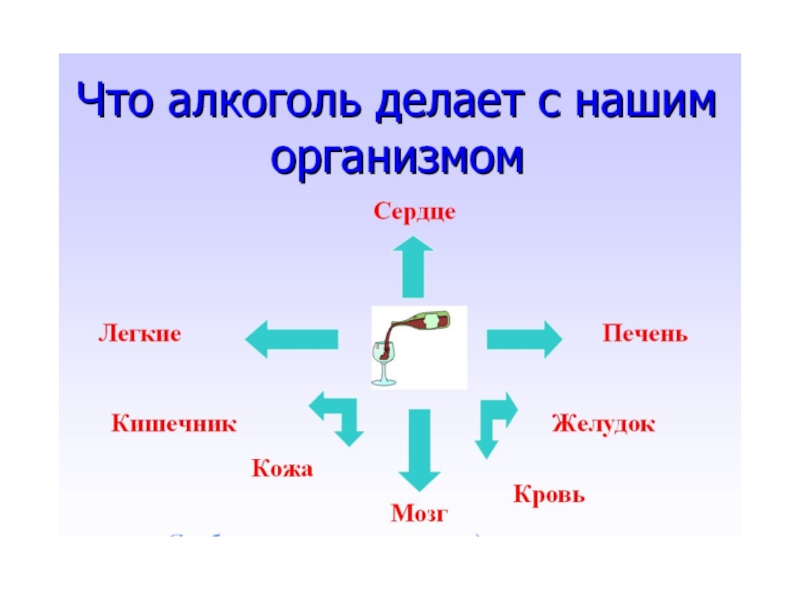
Слайд 17Вредное воздействие этанола на организм человека
При очень большом содержании алкоголя в
крови угнетается активность двигательных центров мозга, главным образом страдает функция мозжечка - человек полностью теряет ориентацию
Слайд 18Этиловый спирт является мощным наружным антисептиком и надежным консервантом.
Легко понять: если
вещество вызывает моментальное прекращение жизни и гибель микробов, то такое же действие оно окажет на наш организм.
Слайд 19Всем известно, что в этиловом спирте десятилетиями сохраняются биологические структуры(кусочки тканей,
органы)
Это возможно только потому, что все процессы жизнедеятельности в спирте прекращаются
Это возможно только потому, что все процессы жизнедеятельности в спирте прекращаются
Слайд 20При употреблении алкоголя мышление нарушается!
Несовместимость между антисептическим действием и применением внутрь
в качестве пищевого продукта люди не осознают!
Смерть человека наступает при концентрации этанола в крови - 5 граммов на 1 литр крови.
Смерть человека наступает при концентрации этанола в крови - 5 граммов на 1 литр крови.
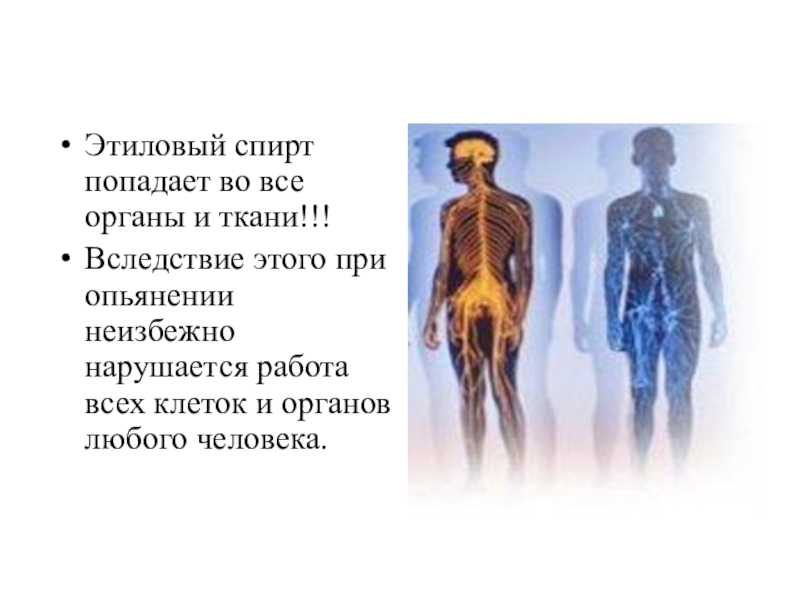
Слайд 21Этиловый спирт попадает во все органы и ткани!!!
Вследствие этого при опьянении
неизбежно нарушается работа всех клеток и органов любого человека.
Слайд 23Очень часто алкоголь является причиной смертельных отравлений. Особенно опасны всевозможные зарубежные
и отечественные суррогаты (заменители) винно- водочного производства.
Слайд 24Применение спиртов
Метанол CH3OH
-производство формальдегида, муравьиной кислоты;
- растворитель.
Этанол С2Н5ОН (этиловый
спирт)
- производство ацетальдегида, уксусной кислоты, бутадиена,
простых и сложных эфиров;
- растворитель для красителей, лекарственных и парфюмерных средств;
- производство ликеро-водочных изделий;
- дезинфицирующее средство в медицине;
- горючее для двигателей, добавка к моторным топливам.
- производство ацетальдегида, уксусной кислоты, бутадиена,
простых и сложных эфиров;
- растворитель для красителей, лекарственных и парфюмерных средств;
- производство ликеро-водочных изделий;
- дезинфицирующее средство в медицине;
- горючее для двигателей, добавка к моторным топливам.
Слайд 25Применение этиленгликоля
Важным свойством этиленгликоля является способность понижать температуру замерзания воды, от
чего вещество нашло широкое применения как компонент автомобильных антифризов и незамерзающих жидкостей.
Он применяется для получения лавсана (ценного синтетического волокна).
Он применяется для получения лавсана (ценного синтетического волокна).
Слайд 26Применение глицерина
Применяется в производстве взрывчатых веществ нитроглицерина.
При обработке кожи.
Как компонент
некоторых клеёв.
При производстве пластмасс глицерин используют в качестве пластификатора.
В производстве кондитерских изделий и напитков (как пищевая добавкаE422)
При производстве пластмасс глицерин используют в качестве пластификатора.
В производстве кондитерских изделий и напитков (как пищевая добавкаE422)